
| A. | Na2FeO4 能与水缓慢反应生成Fe(OH)3 和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 太阳能、风能是可再生能源,应大力推广太阳能、风能的使用 | |
| D. | 新型能源生物柴油和矿物油的主要化学成分相同 |
分析 A.Na2FeO4具有强氧化性,生成的Fe(OH)3胶体具有吸附性;
B.烤蓝生成一层致密的Fe3O4,可保护内部金属;
C.太阳能、风能是可再生能源,来源易得,且对环境无污染;
D.矿物油的成分为烃类物质,生物柴油是生物质能的一种,它是生物质利用热裂解等技术得到的一种长链脂肪酸的单烷基酯.
解答 解:A.Na2FeO4具有强氧化性,生成的Fe(OH)3胶体具有吸附性,则可用作水的消毒剂和净化剂,故A正确;
B.烤蓝生成一层致密的Fe3O4,可保护内部金属,则能起到防腐蚀作用,故B正确;
C.太阳能、风能是可再生能源,来源易得,且对环境无污染,则应大力推广太阳能、风能的使用,故C正确;
D.生物柴油是指以油料作物、野生油料植物和工程微藻等水生植物油脂以及动物油脂、餐饮垃圾油等为原料油通过酯交换工艺制成的可代替石化柴油的再生性柴油燃料,是一种长链脂肪酸的单烷基酯,而矿物油的成分为多种烃混合物,两者成分不同,故D错误.
故选D.
点评 本题考查化学与生活、环境的关系,为高考常见考题,为理综中化学选择题首先出现的习题,涉及知识面较广,侧重分析与应用、化学与生活、环境等综合知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.1 mol•L-1KCIO3溶液中含有的氯离子数目为NA | |
| B. | 标准状况下,22.4L H2O含有的分子数目为NA | |
| C. | 16g O2与16gO3含有的氧原子数目相等 | |
| D. | 1 mol Zn变为Zn2+时失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
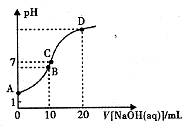 常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )
常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c( HA -)>c(H+)>c(A2一)>c(H2A) | |
| C. | C点:c(Na+)=c(HA-)+2c( A2-) | |
| D. | 水电离出来的c(OH-):B点>D点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:
原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 标准状况下,2.24 L NH3和CH4的混合气体,所含电子总数为2NA | |
| C. | 7.1 g Cl2与足量的铁反应转移的电子数目是0.3NA | |
| D. | 1 mol C5H12分子中共价键总数为16NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com