
| A. | 容量瓶 | B. | 试管 | C. | 烧瓶 | D. | 烧杯 |
科目:高中化学 来源: 题型:选择题
| A. | 石油的催化裂化可得到较多的轻质油 | |
| B. | “西气东输”中输送的气体主要是乙烯 | |
| C. | 煤间接液化的主要目的是获得各种芳香烃 | |
| D. | 石油通过常压分馏可以得到石蜡等相对分子质量较大的烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 的化学反应方程式
的化学反应方程式 、
、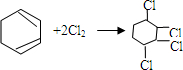 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同位素 | B. | O2和O3的相互转化是物理变化 | ||
| C. | 等质量的O2和O3含有的原子数相同 | D. | 等体积的O2和O3含有的分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH=CHCH2CH3 | B. | CH2=CHCH2CH2CH3 | ||
| C. | CH3CH=CHCH2CH2CH3 | D. | CH3CH2CH=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ•mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:| 化学键 | H-H | O-H | C-H |  |
| E/(kJ•mol-1) | 436 | 465 | 413 | 1076 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com