
已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“金哥”;②合理利用核能符合“低碳经济”的要求,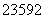 U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列有关对上述表述所涉及元素的说法正确的是( )
U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列有关对上述表述所涉及元素的说法正确的是( )
A.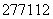 Cn的原子核内中子数与核外电子数之差为55
Cn的原子核内中子数与核外电子数之差为55
B.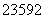 U和
U和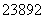 U是同位素,核反应属于化学变化
U是同位素,核反应属于化学变化
C.40Ca2+与18O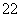 具有相同的电子数
具有相同的电子数
D.Si2O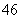 中质子总数为80
中质子总数为80
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是____ ______________(用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________________。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于________(已知Ksp[Cu(OH)2]=2.0×10-20)。
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈________性。在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO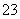 水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以氨气代替氢气研发氨燃料电池是当前科研的一个热点。
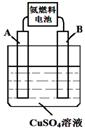 (1)氨燃料电池使用的电解质溶液是2 mol·L-1的KOH溶液,电池反应为:4NH3+3O2 =2N2+6H2O。该电池负极的电极反应式为 ;每消耗1.7g NH3转移的电子数目为 。
(1)氨燃料电池使用的电解质溶液是2 mol·L-1的KOH溶液,电池反应为:4NH3+3O2 =2N2+6H2O。该电池负极的电极反应式为 ;每消耗1.7g NH3转移的电子数目为 。
(2)用氨燃料电池电解CuSO4溶液,如右图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。
(3) 纳米级氧化亚铜(Cu2O)是一种重要光电材料。现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为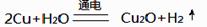 。
。
铜棒上发生的电极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素原子的核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:

(1)写出F的电子式 。
(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(3)加热E的水溶液后并灼烧,最终得到的固体为 , 原因为
, 。(用化学反应方程式来表示)
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为: 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2  2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则
2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则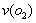 = mol–L-1
= mol–L-1 –min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于 之间。
–min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于 之间。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。

请回答下列问题:
(1)H的电子式是________________,其中含有的化学键类型是___________
_________________。
(2)写出反应④的现象:_______________________________________________________________________________________,
有关反应的化学方程式为_______________________________________________________________________。
(3)已知I的燃烧热是-285.8 kJ·mol-1,则1 m3(标准状况)I完全燃烧,恢复至室温时放出的热量是________(计算结果保留3位有效数字)。
(4)25 ℃时,以Pt为电极电解含有少 量酚酞的F的饱和溶液,则在________(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2 g气体,则此时溶液的pH是________(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
量酚酞的F的饱和溶液,则在________(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2 g气体,则此时溶液的pH是________(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N,写出该反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物分子
C.由共价键形成的分子一定是共价化合物分子
D.只有非金属原子间才能形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:
__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成 具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO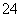 和N2H
和N2H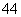 两种离子形式存在,植物的根系极易吸收N4H
两种离子形式存在,植物的根系极易吸收N4H ,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子 不能被植物吸收。下列有关说法不正确的是( )
,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子 不能被植物吸收。下列有关说法不正确的是( )
A.N4和N2互为同素异形体
B.14N与14C互为同位素
C.N4H4(SO4)2不能与草木灰混合使用
D.8NH3+4C5OH===N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe2+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀生成,淡黄色固体的物质的量与产生沉淀的质量关系如图2。
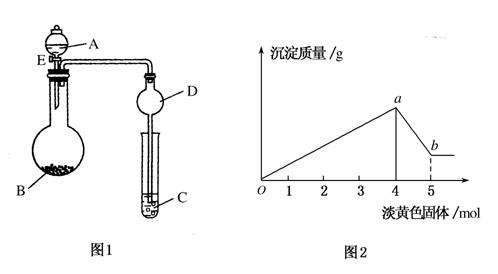
(1)则溶液中含有的阳离子有________。
(2)写出图2曲线a~b段反应的离子方程式________________,________________。
(3)A溶液中存在的阳离子的物质的量浓度之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com