
四氯化锡是无色液体,熔点-33"C,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 ,SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过题1O图装置制备少量SnCl4 (夹持装置略)。
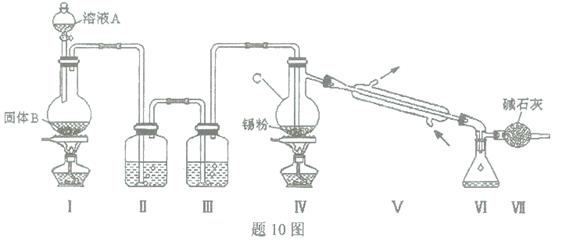
(1)仪器C的名称为 ;
(2)装置Ⅰ中发生反应的离子方程式为 ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为 。
【知识点】化学实验操作 J1J2
【答案解析】

解析:(1)认识常见的化学实验仪器
(2)A为制备氯气装置,在加热条件下进行,应为浓盐酸和二氧化锰的反应
(3)B为饱和食盐水,C为浓硫酸,氯气经除杂,干燥后与锡在D中反应生成SnCl4,因SnCl4极易水解,F可起到防止空气中的水蒸气进入E中
(4)若没有III,则SnCl4会水解产生Sn(OH)4
(5)加热促进SnCl4气化,便于分离
(6)Sn+2Cl2=△= SnCl4,11.9gSn即0.1mol完全反应可生成SnCl426.1g,故产率为23.8/26。1×100%=91.2%
【思路点拨】本题考查了化学实验操作,是两个实验混在一起考查,增大了难度,注意常见的除杂装置。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O===M(OH)n+ H2↑
H2↑
B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
①电解质溶液导电属于化学变化
②碱性氧化物都是金属氧化物
③FeCl2、Fe(OH)3、Fe3O4都能通过化合反应来制取
④Na2O2不是碱性氧化物
A.②③④ B.①④
C.①②③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学所学的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。
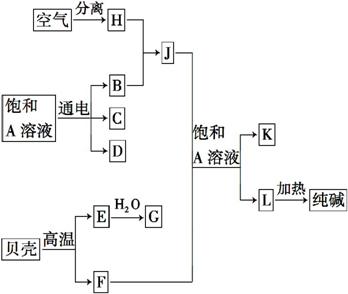
(1)C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式: 。
(2)电解A溶液反应的离子方程式为 。若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为 L。
(3)实验室可用K与G固体加热制取J,写出该反应的化学方程式:___________
___________________________________________________________________。
(4)在制取L的反应过程中,向饱和A溶液先通入J,还是先通入F,其原因是___
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示实验合理的是( )
A.图1为证明非金属性强弱:S > C > Si B.图2为制备少量氧气
C.图3为配制一定浓度硫酸溶液 D.图4为制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
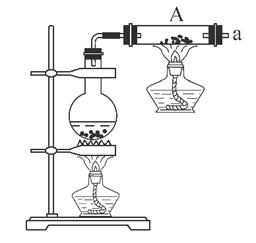
(1)铁粉与水蒸气反应的化学方程式是: ;
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a— ,描述能证明气体产物的实验现象_ ;
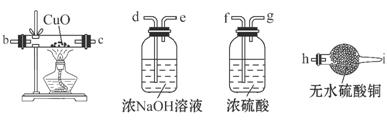
(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法: ;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(用化学方程式说明): ;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是: ;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如下图所示的装置: 通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
A.电源中的a为正极,b为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:
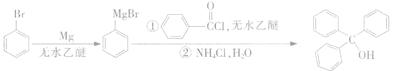
实验步骤如下:
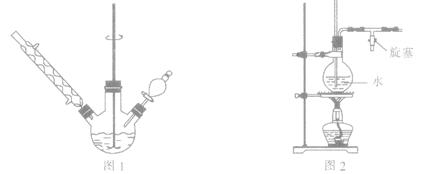
①如图1所示,在三颈烧瓶中加入1.5 g镁屑,在滴液漏斗中加入6.7 mL溴苯和无水乙醚,先加人1/3混合液于烧瓶中,待镁屑表面有气泡产生时,开始搅拌,并逐滴加入余下的混合液,使反应液保持微沸状态,至反应完全。
②继续加入3.7 g苯甲酰氯和无水乙醚,水浴回流l h 后,在冷水浴下慢慢滴加氯化铵的饱和溶液30.0 mL。
③将三颈烧瓶内的物质水浴加热蒸去乙醚,然后加入30.0 mL水进行水蒸气蒸馏(图2用作水蒸气发生装置),直至无油状物蒸出。
④冷却抽滤,将固体用80.0%的乙醇溶液重结晶,最终得到产品。
(1)步骤①中“逐滴加入余下的混合液”是为了防止 。
(2)若水蒸气蒸馏装置中出现堵塞现象,则图2玻璃管中水位会突然升高,此时应 ,待故障排除后再进行蒸馏。
(3)抽滤用到的主要仪器有气泵、 ,抽滤优于普通过滤的显著特点是 。
(4)步骤④中用80.0%的乙醇溶液重结晶的目的是 。
(5)用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com