
| A. | 刷牙时适当使用含氟牙膏能够预防龋齿 | |
| B. | 缺锌的人可以服用硫酸锌糖浆或葡萄糖酸锌等补锌 | |
| C. | 人体内缺铁会使成人患甲状腺肿大 | |
| D. | 天然蛋白质水解的产物都是α-氨基酸 |
分析 A.氟元素能形成氟磷灰石,在牙齿表面形成保护层;
B.硫酸锌糖浆或葡萄糖酸锌都含有能够被人体吸收的锌;
C.人体内缺铁会引起贫血,缺碘会引起甲状腺肿大;
D.依据构成天然蛋白质氨基酸结构解答.
解答 解:A.氟元素能形成氟磷灰石,在牙齿表面形成保护层,含氟牙膏能有效预防龋齿,故A正确;
B.硫酸锌糖浆或葡萄糖酸锌都含有能够被人体吸收的锌,可以用于人体补锌,故B正确;
C.人体内缺铁会引起贫血,缺碘会引起甲状腺肿大,故C错误;
D.构成天然蛋白质氨基酸都是α-氨基酸,故D正确;
故选:C.
点评 化学来源于生产、生活,也服务于生产、生活,与人类生产、生活相关的知识历来是考查的热点,特别是关于食品加工及安全,易燃易爆物的安全知识,材料、能源、环保,化学元素、营养素与人体健康,生活经验或常识等内容,注意对相关知识的积累.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
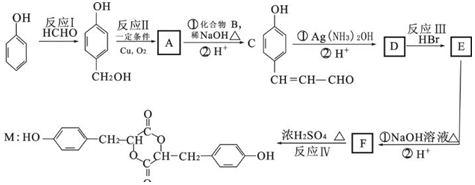
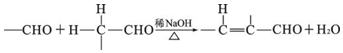
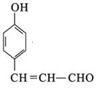 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O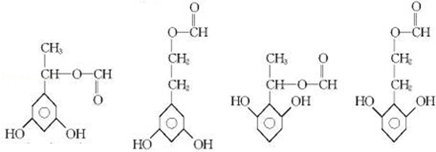 种.
种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
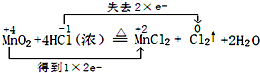 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| B. | 石灰石溶于稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 少量的氢氧化钡与硫酸氢钠溶液混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
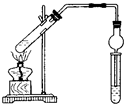 用图所示实验装置制取乙酸乙酯.回答以下问题:
用图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、Al3+、SO42- | B. | Ba2+、Na+、SO42-、MnO4- | ||
| C. | K+、Cl-、HCO3-、CH3COO- | D. | Cu2+、NH4+、NO3-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com