
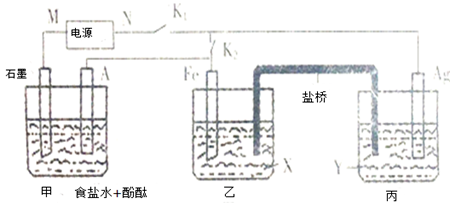
分析 关闭K1,断开K2,乙和丙构成原电池,甲是电解池,Fe是负极,Ag是正极,银电极发生反应:Ag++e-=Ag,银电极增重2.16g,即析出金属银0.02mol,转移电子是0.02mol,
(1)Ag是正极,N是阳极,根据电极反应:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,结合电子转移进行计算;
(2)石墨电极是阴极,发生还原反应,在原电池的正极上发生还原反应;
(3)根据电解原理,甲装置产生氢氧化钠,乙装置发生电极反应Fe-2e-=Fe2+,将甲、乙装置中的溶液全部混合在一起,亚铁离子和氢氧根离子之间反应生成氢氧化亚铁沉淀;
(4)根据盐桥原电池的构成特点,金属铁应该插入含有亚铁离子的盐溶液中,金属银插入含有银离子的盐溶液中.
解答 解:关闭K1,断开K2,乙和丙构成原电池,甲是电解池,Fe是负极,Ag是正极,银电极发生反应:Ag++e-=Ag,银电极增重2.16g,即析出金属银0.02mol,转移电子是0.02mol,
(1)Ag是正极,N是阳极,根据电极反应:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,转移电子0.02mol,所以生成氢氧化钠物质的量是0.02mol,所以c(NaOH)=$\frac{0.02mol}{2L}$=0.01mol/L,所以pH=12,故答案为:阳;12;
(2)石墨电极是阴极,发生反应:2H++2e-=H2↑,丙中发生反应:Ag++e-=Ag,阳离子浓度减小,故答案为:2H++2e-=H2↑;减小;
(3)5min时停止通电,将甲、乙装置中的溶液全部混合在一起,甲装置产生氢氧化钠是0.02mol,乙装置发生电极反应Fe-2e-=Fe2+,转移电子0.02mol,生成亚铁离子是0.02mol,将甲、乙装置中的溶液全部混合在一起,亚铁离子和氢氧根离子之间反应生成氢氧化亚铁沉淀,从理论上讲,得到的沉淀是氢氧化亚铁0.02mol,质量是0.02mol×90g/mol=1.8g,故答案为:1.8;
(4)根据盐桥原电池的构成特点,金属铁应该插入含有亚铁离子的盐溶液中,金属银插入含有银离子的盐溶液中,所以X、Y应该分别为Fe(NO3)2,AgNO3.
故选A.
点评 本题考查学生电解池和原电池的工作原理以及电极反应式的书写和计算知识,难度中等.


科目:高中化学 来源: 题型:解答题
 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸是日常生活中常见的弱酸.
醋酸是日常生活中常见的弱酸.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 棕黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol/L | B. | 1mol/L | C. | 1.2mol/L | D. | 0.5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com