


 .
. ,G中官能团的名称为羧基和碳碳双键.
,G中官能团的名称为羧基和碳碳双键. .
. .
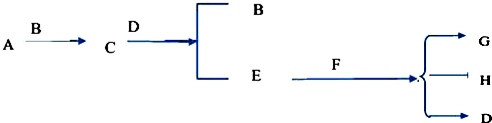
.分析 根据题中各物质转化关系,G在浓硫酸作用下发生酯化反应得H,由H的结构可知G为 ,化合物A和D都是石油裂解气的成分,结合其分子式可知其为不饱和烃,根据A和C的分子式要知,A与溴发生加成反应生成B,B在氢所化钠的醇溶液中发生消去反应生成C,比较D和E的分子式可知,D发生氧化反应生成E,E能与氢氧化铜反应,则E为醛,F为羧酸,结合G的结构可知C和F发生题中信息中的加成反应生成G,根据G可推知C为CH2=CHCH=CHCH3,F为CH2=CHCOOH,所以B为CH3CHBrCHBrCH2CH3,A为CH3CH=CHCH2CH3,E为CH2═CHCHO,D为CH2═CHCH3,据此答题.
,化合物A和D都是石油裂解气的成分,结合其分子式可知其为不饱和烃,根据A和C的分子式要知,A与溴发生加成反应生成B,B在氢所化钠的醇溶液中发生消去反应生成C,比较D和E的分子式可知,D发生氧化反应生成E,E能与氢氧化铜反应,则E为醛,F为羧酸,结合G的结构可知C和F发生题中信息中的加成反应生成G,根据G可推知C为CH2=CHCH=CHCH3,F为CH2=CHCOOH,所以B为CH3CHBrCHBrCH2CH3,A为CH3CH=CHCH2CH3,E为CH2═CHCHO,D为CH2═CHCH3,据此答题.
解答 解:根据题中各物质转化关系,G在浓硫酸作用下发生酯化反应得H,由H的结构可知G为 ,化合物A和D都是石油裂解气的成分,结合其分子式可知其为不饱和烃,根据A和C的分子式要知,A与溴发生加成反应生成B,B在氢所化钠的醇溶液中发生消去反应生成C,比较D和E的分子式可知,D发生氧化反应生成E,E能与氢氧化铜反应,则E为醛,F为羧酸,结合G的结构可知C和F发生题中信息中的加成反应生成G,根据G可推知C为CH2=CHCH=CHCH3,F为CH2=CHCOOH,所以B为CH3CHBrCHBrCH2CH3,A为CH3CH=CHCH2CH3,E为CH2═CHCHO,D为CH2═CHCH3,
,化合物A和D都是石油裂解气的成分,结合其分子式可知其为不饱和烃,根据A和C的分子式要知,A与溴发生加成反应生成B,B在氢所化钠的醇溶液中发生消去反应生成C,比较D和E的分子式可知,D发生氧化反应生成E,E能与氢氧化铜反应,则E为醛,F为羧酸,结合G的结构可知C和F发生题中信息中的加成反应生成G,根据G可推知C为CH2=CHCH=CHCH3,F为CH2=CHCOOH,所以B为CH3CHBrCHBrCH2CH3,A为CH3CH=CHCH2CH3,E为CH2═CHCHO,D为CH2═CHCH3,
(1)根据上面的分析可知,反应①~⑥中属于加成反应的是①⑤,属于氧化反应的是③④,
故答案为:①⑤;③④;
(2)反应④的化学方程式为CH2═CHCHO+2Cu(OH)2 $\stackrel{△}{→}$CH2═CHCOOH+Cu2O↓+2H2O,
故答案为:CH2═CHCHO+2Cu(OH)2 $\stackrel{△}{→}$CH2═CHCOOH+Cu2O↓+2H2O;
(3)根据上面的分析可知,G为 ,含有的官能团为羧基和碳碳双键,
,含有的官能团为羧基和碳碳双键,
故答案为: ;羧基和碳碳双键;
;羧基和碳碳双键;
(4)反应⑥的化学方程式为 ,
,
故答案为: ;
;
(5)C为CH2=CHCH=CHCH3,是不对称烯,所以化合物C与化合物F反应还可以生成化合物G的同分异构体,其结构简式为 ,
,
故答案为: .
.
(6)根据化合物H的结构简式可知,
A.化合物H中有酯基,在一定温度下能与NaOH溶液发生水解反应,故A正确;
B.化合物H的分子式为C10H16O2,故B错误;
C.1mol化合物H与H2发生加成反应,消耗1mol H2,故C错误;
D.化合物H中有碳碳双键,能使溴水褪色,故D正确,
故选AD.
点评 本题考查有机物的结构与性质、化学方程式的书写、有机物的推断等,题目难度不大,注意常见有机物的性质即可解答该题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Al3+、NO3- | B. | Na+、Al3+、Cl-、Fe2+ | ||
| C. | OH-、Al3+、Cl-、NO3- | D. | OH-、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液呈中性 | |
| B. | 溶液pH相差3,则c(H+)相差30倍 | |
| C. | pH=5的HCl加水稀释1000倍后,溶液pH=8 | |
| D. | pH=5的CH3COOH溶液酸性比pH=6的HCl溶液的酸性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com