
【题目】H是合成抗炎药洛萦洛芬钠的关键中间体,它的一种合成路线如下:
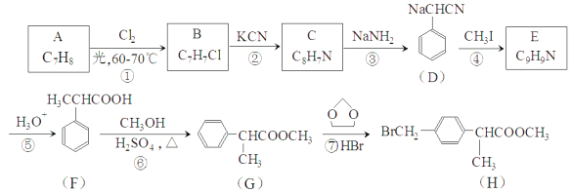
(1)A的物质名称为___________,H中官能团名称是___________。
(2)E的结构简式为___________,反应②的反应类型为___________。
(3)反应①的化学方程式为___________,反应⑥的化学方程式为___________。
(4)写出满足下列条件的F的同分异构体的结构简式___________。
I.能发生水解反应生成酸和醇
Ⅱ.能发生银镜反应
Ⅲ.核磁共振氢谱有5组峰且峰面积之比为3:2:2:2:1
(5)仿照H的合成线,设计一种由![]() 合成
合成![]() 的合成路线______________________。
的合成路线______________________。
【答案】甲苯 溴原子、酯基 ![]() 取代反应
取代反应 ![]()
![]()
![]()
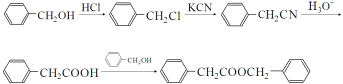
【解析】
由D结构简式知,A中含有苯环,结合A分子式知,A为![]() ,由B分子式及D结构简式知,A发生甲基上取代反应生成B,B为
,由B分子式及D结构简式知,A发生甲基上取代反应生成B,B为![]() ,C为
,C为 ,由F结构简式知,④为取代反应,E为
,由F结构简式知,④为取代反应,E为 ,F发生酯化反应生成G,G发生取代反应生成H;
,F发生酯化反应生成G,G发生取代反应生成H;
由![]() 合成
合成![]() ,
,![]() 由
由![]() 、
、![]() 发生酯化反应得到;
发生酯化反应得到;![]() 可以由
可以由![]() 水解得到,
水解得到,![]() 可由
可由![]() 和NaCN反应得到。
和NaCN反应得到。
(1)A为![]() ,物质名称为甲苯,H中官能团名称是溴原子、酯基。
,物质名称为甲苯,H中官能团名称是溴原子、酯基。
(2)E的结构简式为 ,反应②为甲基上氯原子被-CN取代的反应,反应类型为取代反应。
,反应②为甲基上氯原子被-CN取代的反应,反应类型为取代反应。
(3)反应①为甲基上的取代反应,该反应的反应条件为光照,反应①的化学方程式为![]() ,反应⑥为酸和醇的酯化反应,化学方程式为
,反应⑥为酸和醇的酯化反应,化学方程式为![]() 。
。
(4)I.能发生水解反应生成酸和醇,说明含有酯基;Ⅱ.能发生银镜反应,说明含有醛基,Ⅲ.核磁共振氢谱有5组峰且峰面积之比为3:2:2:2:1,满足条件的F的同分异构体的结构简式![]() 。
。
(5)由![]() 合成
合成![]() ,
,![]() 由
由![]() 、
、![]() 发生酯化反应得到;
发生酯化反应得到;![]() 可以由
可以由![]() 水解得到,
水解得到,![]() 可由
可由![]() 和KCN反应得到,
和KCN反应得到,![]() 可以由
可以由![]() 得到,合成路线为
得到,合成路线为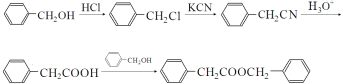


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 用氨水吸收少量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C. FeO和稀HNO3的反应:FeO+2H+=Fe2++H2O
D. 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
(1)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br- → Br2转化的目的是_____,吸收塔中发生反应的离子方程式是________,
②从MgCl2溶液中得到MgCl2.6H2O晶体的主要操作是__________、_________、过滤、洗涤、干燥。
(2)![]()
①灼烧过程中用到的实验仪器有铁三角架、酒精灯、坩埚钳、_____、______。
②操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
③向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
④操作③是分液,则操作②是___________;操作④是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)
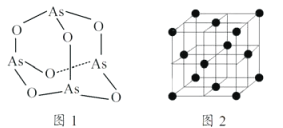
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和焦炭反应生成的产物中含有CO2、SO2、H2O。请回答下列问题:
(1)写出反应的化学方程式______________;
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2、SO2、H2O(g),按气流的方向,各装置的连接顺序是:______。(填序号)

(3)实验时若观察到:①中A瓶溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色, 则A 瓶的作用是______,B瓶的作用是______,C瓶的作用是_______。
(4)装置③中所盛溶液的名称是______,它可以用来验证的气体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的质量数为293,核电荷数为118,其核内中子数和核外电子数分别为( )
A. 118 175B. 118 118C. 193 118D. 175 118
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
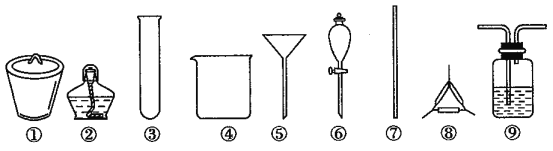
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com