
| X | |||
| Y | Z | W |
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:X>Z |
| C、W的最高价氧化物与水反应形成的化合物是离子化合物 |
| D、X的气态氢化物的水溶液能与Y的最高价氧化物对应水化物发生反应 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
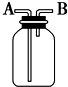
| A、瓶中盛有适量浓H2SO4,从A口进气来干燥NH3 |
| B、从B口进气,用排空气法收集CO2 |
| C、瓶中盛满水,从B口进气,用排水法收集NO2 |
| D、瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验装置保温、隔热效果差 |
| B、量取NaOH溶液的体积时仰视读数 |
| C、分多次把NaOH溶液倒入盛有硫酸的小烧杯中 |
| D、用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
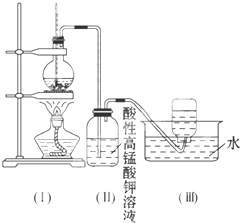 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯:CH3CH2OH
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯:CH3CH2OH| 浓硫酸 |
| ℃170 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1为证明非金属性强弱:S>C>Si |
| B、图2为制备少量氧气 |
| C、图3为配制一定浓度硫酸溶液 |
| D、图4为制备并收集少量NO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com