
分析 X、Y、Z、Q、R、T分别代表原子序数依次增大的短周期元素.X、Y、Z同周期且相邻,都是蛋白质的组成元素,则X为C、Y为N、Z为O;X、T同族,则T为Si;Q与R原子的最外层电子数之和与T原子的最外层电子数相等,则Q、R原子最外层电子数之和为4,二者原子序数大于氧、小于Si,可推知Q为Na、R为Al;U是d区元素,U2+的核外最高能级有2对成对电子,原子外围电子排布为3d74s2,故U为Co;M为第四周期ds区元素,且有未成对电子.则M为Cu.
(1)Q为Na,原子核外电子数为11,根据能量最低原理书写核外电子排布式;
(2)CO2分子结构式为O=C=O,双键中含有1个σ键、1个π键;NO2-离子中N原子价层电子对数为2+$\frac{5+1-2×2}{2}$=3;
(3)Si单质为原子晶体,Al、Na单质为金属晶体,Si单质熔点最高,对于金属晶体,离子电荷越大、离子半径越小,金属键更强,熔点更高;既能与强酸反应,又能与强碱反应的是Al;
(4)通常情况下,Co2+的溶液很稳定,它与NH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[Co(NH3)6]3+,结合电荷守恒、原子守恒配平
(5)Cu2O中Cu的价电子排布式为3d10,处于全满稳定状态;
(6)表示矿物硬度的一种标准称为莫氏硬度;金刚石硬度为10,CSi的硬度为9.5,其晶胞结构与金刚石相似,属于原子晶体,其体心为Si,其它为碳,以顶点碳原子研究,与之最近的碳原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
结合晶胞中含有原子数目表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:X、Y、Z、Q、R、T分别代表原子序数依次增大的短周期元素.X、Y、Z同周期且相邻,都是蛋白质的组成元素,则X为C、Y为N、Z为O;X、T同族,则T为Si;Q与R原子的最外层电子数之和与T原子的最外层电子数相等,则Q、R原子最外层电子数之和为4,二者原子序数大于氧、小于Si,可推知Q为Na、R为Al;U是d区元素,U2+的核外最高能级有2对成对电子,原子外围电子排布为3d74s2,故U为Co;M为第四周期ds区元素,且有未成对电子.则M为Cu.
(1)Q为Na,原子的核外电子排布式为1s22s22p63s1,故答案为:1s22s22p63s1;
(2)CO2分子结构式为O=C=O,双键中含有1个σ键、1个π键,故分子中σ键与π键数目之比为1:1,NO2-离子中N原子价层电子对数为2+$\frac{5+1-2×2}{2}$=3,VSEPR模型为平面三角形,
故答案为:1:1;平面三角形;
(3)Si单质为原子晶体,Al、Na单质为金属晶体,Si单质熔点最高,由于铝离子半径小于钠离子半径,铝离子所带电荷更多,故金属铝中金属键更强,则Al的熔点高于钠的,故熔点由高到低的顺序是:Si>Al>Na,既能与强酸反应,又能与强碱反应的是Al,属于金属晶体,
故答案为:Si>Al>Na;金属晶体;
(4)通常情况下,Co2+的溶液很稳定,它与NH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[Co(NH3)6]3+,该反应的离子方程式是:4[Co(NH3)6]2++O2+2H2O═4[Co(NH3)6]3++4OH-,
故答案为:4[Co(NH3)6]2++O2+2H2O═4[Co(NH3)6]3++4OH-;
(5)CuO中铜的价电子排布式为3d9,Cu2O中Cu的价电子排布式为3d10,后者处于全满稳定状态,前者不是,故高温时能生成Cu2O,
故答案为:CuO中铜的价电子排布式为3d9,Cu2O中Cu的价电子排布式为3d10,后者处于全满稳定状态,前者不是,故高温时能生成Cu2O;
(6)应用划痕法将棱锥形金刚钻针刻划所试矿物的表面而发生划痕,表示矿物硬度的一种标准称为莫氏硬度,金刚石硬度为10,CSi的硬度为9.5,其晶胞结构与金刚石相似,属于原子晶体;其体心为Si,其它为碳,以顶点碳原子研究,与之最近的碳原子处于面心,每个顶点为8个晶胞共用.每个面心为2个晶胞共用,故在晶体中每个X原子周围最近的X原子数目为$\frac{8×3}{2}$=12个;晶胞中含有4个Si原子、4个C原子,晶胞质量为4×$\frac{40}{{N}_{A}}$g,若晶胞的边长为apm,则XT的密度表达式为4×$\frac{40}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{4×40}{(a×1{0}^{-10})^{3}×{N}_{A}}$g/cm3,
故答案为:莫氏硬度;12;$\frac{4×40}{(a×1{0}^{-10})^{3}×{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、价层电子对互斥理论、晶体类型与性质、配合物、晶胞计算等,(6)中注意识记中学常见晶胞结构.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
 )中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
)中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.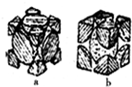
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 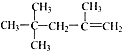 2,2,4-三甲基一4 一戊烯 2,2,4-三甲基一4 一戊烯 | |
| B. |  l,3,4一三甲苯 l,3,4一三甲苯 | |
| C. | CH3CH(CH3)CH(OH)CH3 2-甲基-3-丁醇 | |
| D. |  3,3,4-三甲基己烷 3,3,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 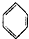 +CH2=CH2→ +CH2=CH2→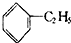 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I- 可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50 mL该溶液与过量Zn充分反应,生成0.56 g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
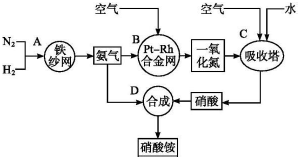
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “两水”都能与FeCl2溶液反应 | |
| B. | “两水”中都存在可逆反应 | |
| C. | “两水”都有刺激性气味 | |
| D. | “两水”都是混合物,溶液中含有的粒子种类数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
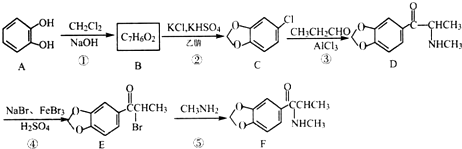
 .
. (填结构简式).
(填结构简式).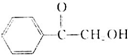 )的合成路线.
)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
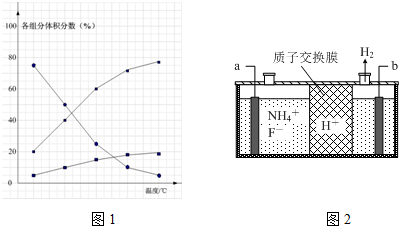
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com