
【题目】H+、Na+、Al3+、Ba2+、OH、![]() 、Cl七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如图所示转化关系(产物H2O未标出),下列说法不正确的是
、Cl七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如图所示转化关系(产物H2O未标出),下列说法不正确的是

A.白色沉淀A可能能溶解在溶液D中
B.在甲中滴加丁可能发生反应:![]() +Ba2++OHBaCO3↓+H2O
+Ba2++OHBaCO3↓+H2O
C.溶液丙与I、![]() 、
、![]() 可以大量共存
可以大量共存
D.溶液甲中一定满足:c(H2CO3)+c(H+)=c(OH)+c(![]() )
)
【答案】C
【解析】
根据图中信息,甲溶液与丙溶液反应生成NaCl和无色气体,根据给定的7种离子,出现的气体只能为二氧化碳,则可确定两溶液为盐酸、碳酸氢钠,溶液甲可以与其他物质反应生成沉淀及气体,则甲溶液为碳酸氢钠,丙溶液为盐酸;甲溶液与乙溶液反应既有气体又有沉淀,可知乙溶液为氯化铝;丁溶液为氢氧化钡;据此解答。
A. 根据分析可知,白色沉淀A为氢氧化铝,能溶解在溶液D(NaOH)中,A正确;
B. 溶液甲为碳酸氢钠溶液,向其中滴加丁(氢氧化钡)能发生反应:![]() +Ba2++OHBaCO3↓+H2O,B正确;
+Ba2++OHBaCO3↓+H2O,B正确;
C. 溶液丙为盐酸与I、![]() 、
、![]() ,酸性溶液中硝酸根离子氧化碘离子不能大量共存,C错误;
,酸性溶液中硝酸根离子氧化碘离子不能大量共存,C错误;
D. 溶液甲为碳酸氢钠溶液,根据溶液呈电中性c(Na+)+c(H+)=c(OH)+2c(![]() )+c(HCO3-),跟据物料守恒,c(Na+)=c(
)+c(HCO3-),跟据物料守恒,c(Na+)=c(![]() )+c(H2CO3)+c(HCO3-),代入第一个等式即可得到c(H2CO3)+c(H+)=c(OH)+c(
)+c(H2CO3)+c(HCO3-),代入第一个等式即可得到c(H2CO3)+c(H+)=c(OH)+c(![]() ),D正确;
),D正确;
答案为C。


科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,根据元素a~j在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | a | |||||||
2 | b | c | d | e | ||||
3 | f | g | h | i | j | |||
(1)f、g、h的单质分别与水反应,最剧烈的是___________(填元素符号)。
(2)c、i的氢化物稳定性较强的是____________(填化学式)。
(3)c、f可形成既含离子键又含非极性键的化合物,该化合物的电子式为__________。
(4)d、f、g的离子半径最大的是_______________(填离子符号)。
(5)f的最高价氧化物的水化物与h的最高价氧化物的水化物反应的离子方程式为:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.1mol硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA 个氢原子
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+
D.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有着非常重要的意义。
(一)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
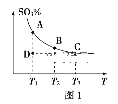
①2SO2(g)+O2(g)![]() 2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
②若反应进行到状态D时,v(正)___v(逆)(填“>”“<”或“=”)。
(二)工业上合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。

从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
A.a B.b C.c D.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制备高纯度的硫酸锰晶体,其流程如下图所示:
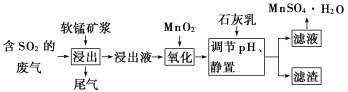
已知:
①浸出液中的金属阳离子主要是![]() ,还含有少量的
,还含有少量的![]() 、
、![]() 等,且
等,且![]() .
.
②几种离子开始沉淀和完全沉淀时的pH如表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.7 |
| 2.7 | 3.7 |
| 3.8 | 4.7 |
| 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:_____________.
(2)用离子方程式表示加入二氧化锰的作用:________________________________.
(3)从表中数据来看,________(填“能”或“不能”)取消“加入二氧化锰”的步骤,原因是________________________.
(4)下列试剂能替代二氧化锰的是________(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(5)有同学认为可以用碳酸锰![]() 或氢氧化锰
或氢氧化锰![]() 替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
(6)从含硫酸锰的滤液中提取硫酸锰晶体的操作是_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com