
 ��ͼ��ʾ��װ���У�a��b�Ƕ��Ե缫���׳���ʢ��NaCl�ͷ�̪�Ļ��Һ���ҳ���ʢ��200mLCuSO4��Һ��ͨ��һ��ʱ���a�������ʺ�ɫ���밴Ҫ����գ�
��ͼ��ʾ��װ���У�a��b�Ƕ��Ե缫���׳���ʢ��NaCl�ͷ�̪�Ļ��Һ���ҳ���ʢ��200mLCuSO4��Һ��ͨ��һ��ʱ���a�������ʺ�ɫ���밴Ҫ����գ�
| ||
| 0.64g |
| 64g/mol |
| ||
| 0.02mol |
| 0.2L |


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | X | Y | Z | W |
| ԭ�Ӱ뾶/pm | 160 | 143 | 70 | 66 |
| ��Ҫ���ϼ� | +2 | +3 | +5��+3��-3 | -2 |
| A��X��YԪ�صĽ����� X��Y |
| B��X��Y��Z��W�ĵ��ʶ����п�ȼ�� |
| C��Y������������Ӧ��ˮ����������ϡ��ˮ |
| D��һ�������£�W���ʿ�����Z���⻯�ﷴӦ����ZW |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij��ѧ��ȤС����ѧϰ�����ἰ���ε�ijЩ��������;���У���������ʵ��̽����
ij��ѧ��ȤС����ѧϰ�����ἰ���ε�ijЩ��������;���У���������ʵ��̽����
- 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���Ӵ��� | a | e | H |
| ԭ�Ӻ��� | ���� | ���� | �ĺ� |
| ���ӵĵ���� | һ����λ����� | һ����λ����� | 0 |
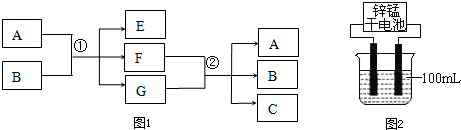
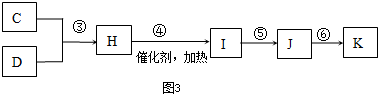
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | X | Y | Z | L | M | Q |
| ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| ��Ҫ���ϼ� | +2 | +3 | +6��-2 | +7��-1 | +4��-4 | -2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��ˮ�ⷴӦ�ǵ��͵Ŀ��淴Ӧ��ˮ�ⷴӦ�Ļ�ѧƽ�ⳣ����Ϊˮ�ⳣ������Kh��ʾ����Na2CO3��һ��ˮ�ⷴӦ��ˮ�ⳣ���ı�ʾʽ Kh��
| ||||||
| B��HS-��������ӷ���ʽ��HS-+H2O?H3O++S2- | ||||||
| C��N2��g��+3H2��g��?2NH3��g����H��0��������������ʱ�����¶ȣ���Ӧ����V��H2����������ƽ��ת���ʱ�С | ||||||
D��CO��g����ȼ������283.0kJ?mol-1�����ʾCO��g����ȼ���ȵ��Ȼ�ѧ����ʽΪ��CO��g��+
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | A | B | C | D |
| ʵ�� ���� |
 ʳ��ˮ |
 Ƭ�̺���Fe�缫��������K3[Fe��CN��6]��Һ |
 |
 ���ڹ����� |
| ʵ�� Ŀ�� |
��֤�������� ���ⸯʴ |
��֤Fe�缫������ | ��֤��Ȳ�Ļ�ԭ�� | ��֤�������������� ��ѧ��Ӧ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com