
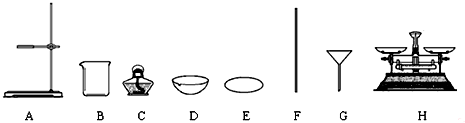
分析 (1)根据实验室常见仪器判断D为蒸发皿;
(2)粗盐提纯实验的操作步骤为溶解、过滤、蒸发;
(3)如果滤纸边缘高于漏斗边缘,过滤器内的液体极有可能溢出;如果漏斗内液面高于滤纸边缘,液体也会顺着漏斗与滤纸间的夹缝流下,这样都会导致过滤失败;
(4)烧杯在溶解时作容器,在过滤时盛接滤液;玻璃棒的作用是搅拌加速溶解、引流、搅拌使物质受热均匀.
解答 解:(1)根据实验室常见仪器可知,D为蒸发皿;
故答案为:蒸发皿;
(2)粗盐提纯是通过把粗盐配制成溶液--溶解,把不溶物除去--过滤,把食盐从溶液中分离出来而得到精盐--蒸发的过程;
故答案为:蒸发;
(3)如果滤纸边缘高于漏斗边缘,过滤器内的液体极有可能溢出;如果漏斗内液面高于滤纸边缘,液体也会顺着漏斗与滤纸间的夹缝流下,这样都会导致过滤失败,所以二低的含义为:滤纸上沿低于漏斗边缘,液面低于滤纸上沿;
故答案为:滤纸上沿低于漏斗边缘,液面低于滤纸上沿;
(4)在溶解过程中利用烧杯作容器,玻璃棒作搅拌棒;在过滤时利用烧杯盛接滤液,利用玻璃棒引流;在蒸发时利用玻璃棒搅拌,使溶液均匀受热.
故答案为:烧杯;F;3.
点评 本题考查了有关粗盐的提纯、以及基本实验操作,侧重分析与应用能力的考查,注重常见仪器的名称以及使用方法的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
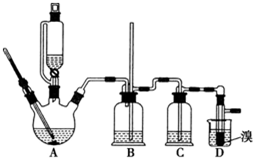 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
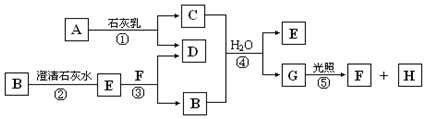 图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).
图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com