
已知SO32-+I2+H2O=SO42-+2I-+2H+。某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色。则下列关于该溶液组成的判断正确的是
A.肯定不含I- B.肯定不含Cu2+ C.可能含有SO32- D.肯定不含有NH4+
科目:高中化学 来源:2016届辽宁师大附中高三下学期精品考试理综化学试卷(解析版) 题型:填空题
氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
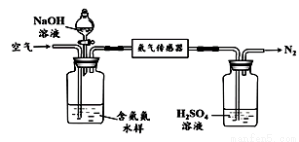
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
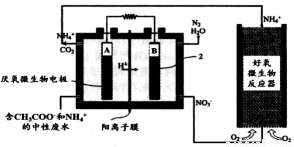
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:填空题
A、B、C、D均为短周期元素,他们的原子序数依次增大,B是构成物质种类最多的元素,B和A组成的化合物 B6 A 6 是一种无色透明的液体,不溶于水,密度比水小,C 是地壳中含量最高的非金属元素,D 在同周期元素中原子半径最大。
(1)A、B、D 的元素名称分别为___________、____________、___________
(2)C 在元素周期表中位置为___________________。
(3)A、C、D 能组成多种不同的化合物,这些化合物中既含有极性共价键又含有离子键的化合物为_______________(写电子式,下同),既含有非极性共价键又含有离子键的化合物为_________________。
(4)A 和 D 能组成一种化学活性很高的离子化合物 DA,DA 能和C的单质 C2反应生成一种强碱,请写出 DA 和 C2反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:实验题
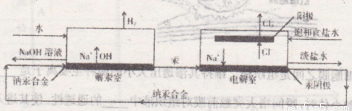
工业上可以用汞阴极法电解NaCl溶液得到烧碱与氯气、氢气,装置见下图:
利用烧碱与氯气还可生产一种高效的多功能的水处理剂高铁酸钾。主要的生产流程如下:
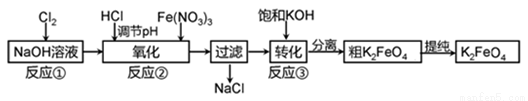
(1)写出汞阴极法的阴极电极反应式_____________;解汞室内的反应化学方程式____________。
(2)反应原理如下:
反应①:Cl2+2NaOH=NaCl+NaClO+H2O
氧化过程化学方程式:______________________;
若加入过量NaClO,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式__________________;
转化过程:Na2FeO4+2KOH=K2FeO4+2NaOH,该过程在某低温下进行的,说明些温度下Ksp(K2FeO4)_____Ksp(Na2FeO4)(填“>”、“<”、“=”)。
(3)实验室在过滤时用到的玻璃仪器有______________________;
(4)既能起到杀菌作用又能起到净水作用,原因是其在水溶液中易水解产生氧气,请写出其水解化学方程式_____________________;
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:选择题
设NA为阿伏加罗常数的值,下列说法正确的是( )
A.34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA
B.反应3H2(g)+N2(g) 2NH3(g) △H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA
2NH3(g) △H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA
C.常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算
D.6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:选择题
某溶液中有NH4+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是
A.NH4+、 Mg2+ B.Mg2+、Fe2+ C.NH4+、Fe2+ D.Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:简答题
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减 小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母)
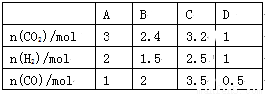
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:选择题
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g) 达到平衡时,c(H2)=1.0 mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=1.0 mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.16 B.20 C.24 D.36
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁师大附中高一下学期6月月考化学试卷(解析版) 题型:选择题

















































 相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)
相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的
2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的 有关数据如下表:
有关数据如下表:
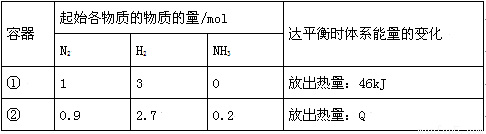
下列叙述错误的是
 A.容器①、②中反应的平衡常数
A.容器①、②中反应的平衡常数 相等
相等
 B.平衡时,两个容器中NH3的体积分数均为1/3
B.平衡时,两个容器中NH3的体积分数均为1/3
 C.容器②中达平衡时放出的热量Q=46 kJ
C.容器②中达平衡时放出的热量Q=46 kJ
 D.若容器①体积为2L,则平衡时放出的热量<46kJ
D.若容器①体积为2L,则平衡时放出的热量<46kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com