



 .
. 分析 (1)元素原子核外M层电子数是L层电子数的一半,M层电子数为4,则为Si;
(2)元素原子的最外层电子数是次外层电子数的1.5倍,原子只能有2个电子层,最外层电子数为3,故为硼元素;
(3)元素的单质在常温下最易和O2反应产生白色固体,则为钠元素;
(4)元素的次外层电子数是最外层电子数的一半,原子只能有2个电子层,最外层电子数为4,故为C.
解答 解:(1)元素原子核外M层电子数是L层电子数的一半,M层电子数为4,则为Si,原子结构示意图为: ,故答案为:硅;
,故答案为:硅; ;
;
(2)元素原子的最外层电子数是次外层电子数的1.5倍,原子只能有2个电子层,最外层电子数为3,故为硼元素,原子结构示意图为: ,
,
故答案为:硼; ;
;
(3)元素的单质单质在常温下最易和O2反应产生白色固体,则为钠元素,原子结构示意图为: ,故答案为:钠;
,故答案为:钠; ;
;
(4)元素次外层电子数是最外层电子数的一半,原子只能有2个电子层,最外层电子数为4,故为C,原子结构示意图为: ,
,
故答案为:碳; .
.
点评 本题考查核外电子排布,比较基础,推断元素是关键,注意理解掌握原子结构示意图的书写.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | V(H2)═0.3 mol/(L•min) | B. | V(N2)═0.1mol/(L•min) | ||
| C. | V(NH3)═0.15mol/(L•min) | D. | V(N2)═0.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 85g | B. | 79g | C. | 116g | D. | 58g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程.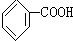 和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式:
和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式: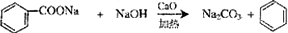 (NaOH参与反应)
(NaOH参与反应)
 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤液中一定含有Al3+、Ag+ | B. | 滤液中一定含有Fe2+、Ag+ | ||
| C. | 滤渣中一定含有Fe | D. | 滤渣中一定含有Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由不同种类的原子构成的物质不可能是单质 | |
| B. | 葡萄糖注射液不能产生丁达尔现象,不属于胶体 | |
| C. | 蔗糖、硫酸钡和氨气分别属于非电解质、强电解质和弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用以下几种常见有机物填写下列空白:
用以下几种常见有机物填写下列空白:| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 104.7g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 318.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
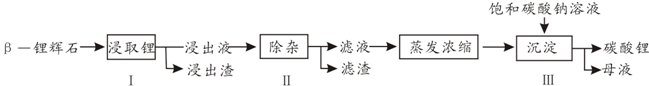
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com