
【题目】冰晶石(Na3 AlF6)难溶于水,广泛应用于铝的冶炼。工业上用萤石(CaF2)为原料生产Na3 AIF6:

回答下列问题:
(1)Na3AIF6为助溶剂,冶炼铝的化学方程式为 。
(2)写出煅烧时总反应的化学方程式为________。
(3)煅烧后的固体在浸取前进行粉碎的目的是____,为达到相同目的,常温浸取时还可采取的措施是____。
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:____。NaF溶液呈碱性,用离子方程式表示其原因: ,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物 。
(5)97.5kg含CaF280%萤石(杂质不含氟元素)理论上可生产Na3 AIF6 kg(设生产过程中的每一步含氟物质均完全转化)。
【答案】(1)2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
(2)CaF2+SiO2↑Na2CO3![]() CaSiO3+2NaF+CO2↑
CaSiO3+2NaF+CO2↑
(3)加速可溶物的溶解充分搅拌
(4)3Na++Al3++6F-=Na2AlF6↓F-+H2O![]() HF+OH-AI(OH)2
HF+OH-AI(OH)2
(5)70
【解析】
试题分析:(1)在铝的冶炼中,Na3AlF6是助熔剂,即降低氧化铝的熔化温度,同时增强体系的导电性,冶炼铝的化学方程式为2Al2O3![]() 4Al+3O2↑;
4Al+3O2↑;
(2)煅烧的化学方程式为CaF2+SiO2↑Na2CO3![]() CaSiO3+2NaF+CO2↑;
CaSiO3+2NaF+CO2↑;
(3)煅烧后的固体在浸取前进行粉碎,可以加快溶解速度,为了加快溶解,可以使用玻璃棒进行,和提高反应温度等措施,故答案为:加速溶解;搅拌;
(4)根据流程图,NaF和硫酸铝混合后生成Na3AlF6沉淀,反应的离子方程式为3Na++Al3++6F-= Na3AlF6↓。NaF属于强碱弱酸盐,溶液水解呈碱性,离子方程式为F-+H2O![]() HF+OH-,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物Al(OH)3;
HF+OH-,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物Al(OH)3;
(5)97.5kg含CaF280%的氟石n(CaF2)=![]() =1000mol,生产过程中的每一步含氟物质均完全转化,根据氟元素守恒:3CaF2~Na3AlF6,n(Na3AlF6)=8×102mol×
=1000mol,生产过程中的每一步含氟物质均完全转化,根据氟元素守恒:3CaF2~Na3AlF6,n(Na3AlF6)=8×102mol×![]() ,m(Na3AlF6)=nM=1000mol×
,m(Na3AlF6)=nM=1000mol×![]() ×210g/mol=70kg。
×210g/mol=70kg。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.标准状况下,1 L庚烷所含有的分子数为![]()
B.1 mol甲基(﹣CH3)所含电子数为9NA
C.标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA
D.26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO![]() 、SO
、SO![]() ,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是
①________,②________,③________,④__________,⑤__________。
(2)图中现象a、b、c表明检验出的离子分别是a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式_________________。
(4)无色溶液C加试剂③的主要目的是_____________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(6)气体E通入试剂④发生反应的离子方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着全球性能源危机和环境恶化的到来,节能减排、低碳经济已成为人类共同的呼声。下列不属于节能减排的是( )
A.分类回收垃圾
B.举行地球一小时熄灯活动
C.大力发展小火力发电厂
D.夏天将空调的温度设置在26度以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
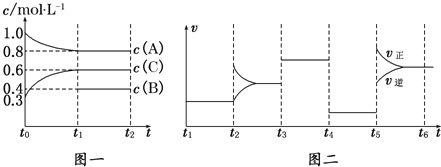
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=______________.
(2)t4~t5阶段改变的条件为______________,B的起始物质的量为______________.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______________.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:______________.
(5)容器乙与容器甲的体积相同且保持不变,且乙容器的温度恒定为甲容器t4~t5时的温度,若要使C的平衡浓度为1.2mol/L,则在乙容器中加入1.2molA、0.6molB的同时还需要加入___________molC。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
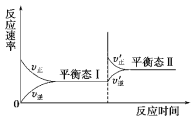
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计正确的是
A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氧化铝溶液,可以用碳酸钱溶液鉴别
C.将CuC12溶液在蒸发皿中加热蒸千,得到无水CuCl2固体
D.检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品![]() 粉碎
粉碎![]() 加水溶解
加水溶解![]() 过滤
过滤![]() 向滤液中滴加KSCN 溶液
向滤液中滴加KSCN 溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com