
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
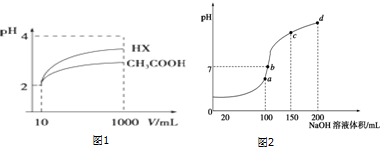
分析 (1)电离平衡常数越大,酸的电离程度越大,溶液酸性越强;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(3)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余,以此解答该题;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)根据表中数据可知,酸的电离出平衡常数大小为:CH3COOH>H2CO3>HCO3->HClO,电离平衡常数越大,酸性越强,所以酸性由强到弱的顺序为为:CH3COOH>H2CO3>HClO,
故答案为:CH3COOH>H2CO3>HClO;
(2)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大,
故答案为:大于;
(3)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于醋酸中酸过量,则反应较快,所以反应所需的时间A>B;故错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故错误;
③由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故正确;
④醋酸的浓度大于盐酸的浓度,则醋酸中反应速率大,所以反应过程中的平均速率 B>A,故正确;
⑤醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故正确;
⑥醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故错误;
故选:③④⑤;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查了弱电解质的电离及其影响和离子浓度大小的比较,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
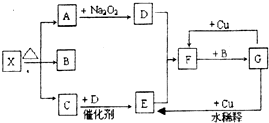 图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
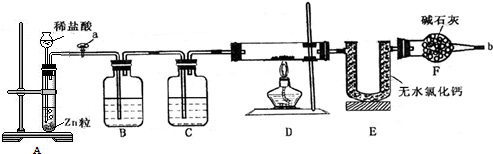
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
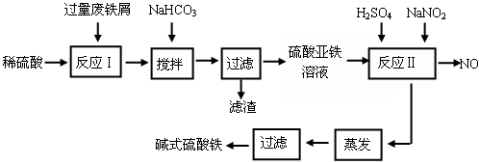
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的分子大小不同 | B. | 气体的物质的量不同 | ||
| C. | 气体的性质不同 | D. | 气体的分子间距离不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸后者多 | D. | 后者放出CO2的量是前者的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常用明矾或硫酸铝做净水剂 | |
| B. | 实验室将氯化铁晶体溶于浓盐酸来配制饱和氯化铁溶液 | |
| C. | 用热的纯碱液清洗餐具表面的油污比用冷的溶液效果好 | |
| D. | 泡沫灭火器中用NaHCO3溶液和Al2(SO4)3溶液发生反应产生CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000aρ}{(50a+m)}$ mol/L | B. | $\frac{aρ}{(46a+m)}$ mol/L | ||
| C. | $\frac{1000aρ}{(46a+m)}$ mol/L | D. | $\frac{1000aρ}{(47a+m)}$ mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com