粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质.我们食用的精盐是用粗食盐提纯而得到的.通过教材中“粗盐的提纯”及你做过的该实验回答下列问题.
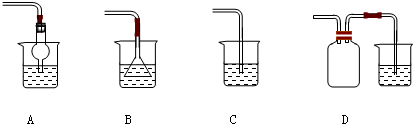
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热.其正确的操作顺序为
①②③④⑤
①②③④⑤
.
(2)如何运用最简方法检验溶液中有无SO
42-离子?
静置片刻后,取上层清液于试管中,继续滴加氯化钡,若出现浑浊或白色沉淀,说明溶液中含有硫酸根,否则不含硫酸根
静置片刻后,取上层清液于试管中,继续滴加氯化钡,若出现浑浊或白色沉淀,说明溶液中含有硫酸根,否则不含硫酸根
.如果有,应该如何除去SO
42-离子?
在溶液中加入过量的BaCl2溶液
在溶液中加入过量的BaCl2溶液
.
(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na
2CO
3溶液,直至不再产生沉淀为止.请问这步操作的目的是
除去Ca2+、Mg2+以及加入过量Ba2+
除去Ca2+、Mg2+以及加入过量Ba2+
.
(4)将经过操作(3)后的溶液过滤.请问这一操作能除掉哪些杂质?
BaSO4、CaCO3、MgCO3、BaCO3等杂质
BaSO4、CaCO3、MgCO3、BaCO3等杂质
.
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时:
搅拌,加速溶解
搅拌,加速溶解
.过滤时:
使待滤液体沿玻璃棒流入漏斗,防止外洒
使待滤液体沿玻璃棒流入漏斗,防止外洒
.蒸发时:
搅拌,防止因局部过热液滴或晶体飞溅
搅拌,防止因局部过热液滴或晶体飞溅
.

 口算能手系列答案
口算能手系列答案