
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
分析 X、Y、Z是三种短周期元素,X通过共用三对电子形成X2分子,则X是N元素,根据元素在周期表中的位置知,Y是S元素、Z是Cl元素,
A.共价化合物中,中心原子价电子数+化合价的绝对值=8,则该分子中所有原子都达到8电子稳定结构,但氢化物除外;
B.X、Y、Z三种元素的最高价含氧酸是强酸,但含氧酸不一定是强酸;
C.氯气具有强氧化性,能氧化硫化氢生成S;
D.处于最高化合价的元素只有氧化性,处于最低价态的元素只有还原性.
解答 解:X、Y、Z是三种短周期元素,X通过共用三对电子形成X2分子,则X是N元素,根据元素在周期表中的位置知,Y是S元素、Z是Cl元素,
A.共价化合物中,中心原子价电子数+化合价的绝对值=8,则该分子中所有原子都达到8电子稳定结构,但氢化物除外,化合物NCl3中N原子价电子数+化合价的绝对值=5+3=8,所以该分子中各原子均满足8电子的稳定结构,故A正确;
B.X、Y、Z三种元素的最高价含氧酸是强酸,但含氧酸不一定是强酸,如亚硝酸、亚硫酸及次氯酸都是弱酸,故B错误;
C.氯气具有强氧化性,能氧化硫化氢生成S,反应方程式为Cl2+H2S═2HCl+S,属于置换反应,故C正确;
D.处于最高化合价的元素只有氧化性,处于最低价态的元素只有还原性,N3-与Al3+有相同的电子数,前者只有还原性,后者只有氧化性,故D错误;
故选AC.
点评 本题考查元素周期表和元素周期律综合应用,为高频考点,正确判断元素是解本题关键,明确元素性质与化合价的关系,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 只要有化学键断裂的变化一定是化学变化 | |
| B. | 并不是所有化学反应的速率都与压强有关 | |
| C. | 可逆反应达到平衡后,正、逆反应速率相等但不为零 | |
| D. | 装有NO2和N2O4混合气的密闭烧瓶加热后,颜色变深,说明该化学平衡发生了移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随物质变化和能量变化 | |
| B. | 元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 | |
| C. | 有些放热反应也需要加热才能发生 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和D2互为同位素 | |
| B. | 金刚石、石墨和“足球稀”C60为同素异形体 | |
| C. | 碳链为 与 与 的烃为同系物 的烃为同系物 | |
| D. |  和 和 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
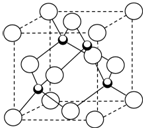 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com