
 ;
; 业生产中M与水反应的产物之一可用于漂泊和杀菌,写出M与水初步反应的化学方程式NCl3+3H2O═NH3+3HClO.
业生产中M与水反应的产物之一可用于漂泊和杀菌,写出M与水初步反应的化学方程式NCl3+3H2O═NH3+3HClO. 分析 W、X、Y、Z是四种常见的短周期元素,Z是地壳中含量最多的元素,则Z为O元素;已知Y的最高价氧化物对应的水化物可与其简单氢化物反应生成盐,则Y为N元素;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N,且原子半径小于N,故X为H元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,Z是地壳中含量最多的元素,则Z为O元素;已知Y的最高价氧化物对应的水化物可与其简单氢化物反应生成盐,则Y为N元素;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N,且原子半径小于N,故X为H元素,
(1)Y为N元素,Y元素在周期表中第二周期ⅤA族,
故答案为:第二周期ⅤA族;
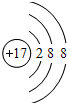
(2)W为Cl元素,氯离子的结构示意图为 ,
,
故答案为: ;
;
(3)Y为N元素,W为Cl元素,由W、Y两种元素组成的一种化合物M分子中,每个原子最外层均达到8电子稳定结构,则该分子为NCl3,NCl3与水反应生成次氯酸,反应的化学方程为NCl3+3H2O═NH3+3HClO,
故答案为:NCl3+3H2O═NH3+3HClO.
点评 本题考查位置结构性质关系等,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用以及题中信息的灵活运用.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
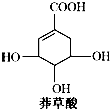
| A. | 分子中含有3种官能团 | B. | 可发生加成、取代、水解反应 | ||
| C. | 分子式为C7H6O5 | D. | 水溶液中羧基和羟基均能电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| C. | 马口铁(镀锡铁)破损时与电解质溶液接触,铁先被腐蚀 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是还原剂,NaOH及H2O均是氧化剂 | |
| B. | 还原产物是H2,且由H2O还原所得的H2与NaOH还原所得的H2物质的量的比为2:1 | |
| C. | 反应中1mol Al失去4mol电子 | |
| D. | 此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
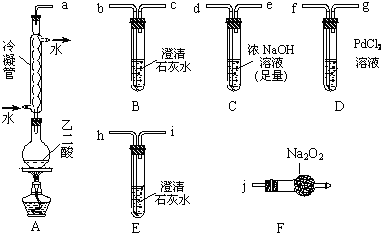
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com