
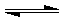
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).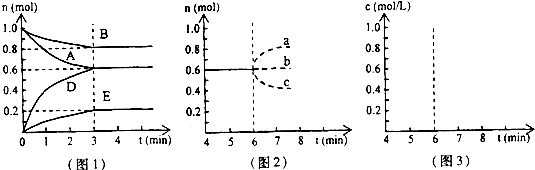
| ||
| 3min |
 3D(g)+E(s),所以平衡常数k=
3D(g)+E(s),所以平衡常数k=| c3(D) |
| c2(A)?c(B) |
| 0.6mol |
| 2L |
| 0.8mol |
| 2L |
| (0.3)3 |
| (0.3)2×0.4 |
 :
:
| (0.45)3 |
| (0.2)2×0.4 |
| 0.4mol |
| 2L |
| 0.6mol |
| 2L |


科目:高中化学 来源:不详 题型:单选题
| A.SO2、SO3、O2的体积分数相等 |
| B.单位时间内生成amolO2的同时生成amolSO3 |
| C.单位时间内消耗amolO2的同时消耗2amolSO2 |
| D.反应若在容积固定的密闭容器中进行,温度一定时,反应混合物的总压强不随时间变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
A. | B. | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| t/min | CO/mol | H2/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.10 |
| 3 | 0.75 | 0.50 | 0.25 |
| 5 | 0.65 | 0.30 | 0.35 |
| 7 | 0.55 | 0.10 | 0.45 |
| 9 | 0.55 | 0.10 | 0.45 |
| 10 | 0.55 | 0.10 | 0.45 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a+b<c+d;△H<0 | B.a+b<c+d;△H>0 |
| C.a+b>c+d;△H>0 | D.a+b>c+d;△H<0 |
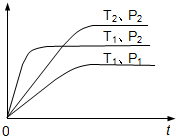
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.升高温度 | B.加大X的投入量 |
| C.增加N的量 | D.缩小容器的体积 |
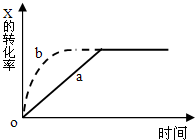
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com