
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| B、实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl-═Cl2↑+Mn2++2H2O | ||||
| C、用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | ||||
| D、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| ||


科目:高中化学 来源: 题型:
| A、③⑤ | B、②③④⑤ |
| C、②⑤⑥⑦ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:
A、硝基苯的结构简式: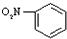 |
| B、葡萄糖的实验式(最简式)为:C6H12O6 |
C、乙酸的分子比例模型图为: |
D、CH3Cl的电子式: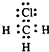 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、修正液的成分对纸张具有强腐蚀性 |
| B、修正液中不含有化学物质 |
| C、修正液是一种胶体,均一、稳定 |
| D、修正液的溶剂易挥发、易燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数是99 |
| B、电子数是43 |
| C、中子数是99 |
| D、质量数是43 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol、0.2mol、0.1mol |
| B、0.2mol、0.3mol、0.2mol |
| C、0.1mol、0.5mol、0.2mol |
| D、0.1mol、0.3mol、0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
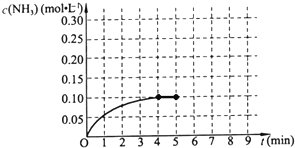 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com