
分析 发生反应:MnO2+4HCl?MnCl2+Cl2↑+2H2O,根据n=$\frac{m}{M}$计算二氧化锰物质的量,再根据方程式计算生成氯气物质的量,被氧化的HCl生成氯气,根据氯原子守恒计算被氧化HCl的物质的量,根据V=nVm计算氯气体积,结合氯元素化合价变化计算转移电子数目.
解答 解:870g MnO2 的物质的量为$\frac{870g}{87g/mol}$=10mol,
由MnO2+4HCl?MnCl2+Cl2↑+2H2O,可知n(Cl2)=n(MnO2)=10mol,
被氧化的HCl生成氯气,根据氯原子守恒,可知被氧化HCl的物质的量为10mol×2=20mol,
标况下,生成氯气的体积为10mol×22.4L/mol=224L,
转移电子数目为20mol×1×6.02×1023mol-1=1.204×1025,
答:被氧化的氯化氢的物质的量是20mol,产生的氯气在标况下的体积为224L,反应中转移的电子数目为1.204×1025.
点评 本题考查化学方程式计算、氧化还原反应计算等,难度不大,注意参加反应的盐酸与被氧化的盐酸的物质的量的关系.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
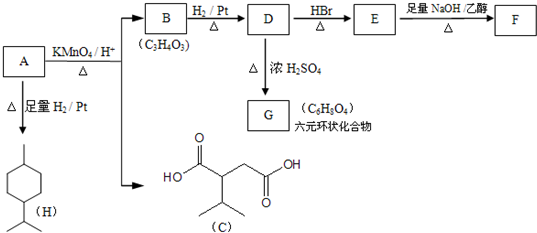
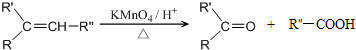
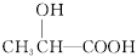 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +2H2O.
+2H2O.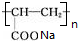 .
.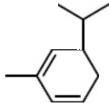 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与Y可以形成离子化合物 | |
| B. | X的简单氢化物在同主族元素的氢化物中沸点最高,说明X的非金属性最强 | |
| C. | X和Z形成的原子个数1:1的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z的熔融氧化物来制取Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
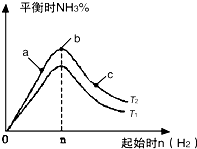 (1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com