
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
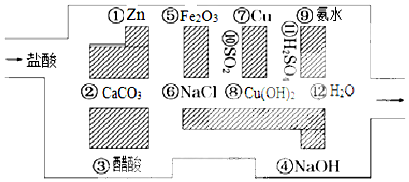
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.
某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.| 序号 | 选用指示剂 | 选用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
| 试验编号 | 待测盐酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 20.00 |
| ② | 25.00 | 1.10 | 21.30 |
| ③ | 25.00 | 0.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
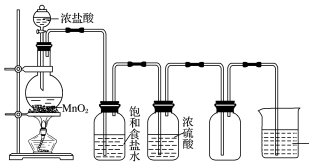
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com