
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )

A. A为正极
B. 电池工作时H+由A极向B极迁移
C. 从b 口通入四氧化二氮气体且在B极发生氧化反应
D. A极发生的电极反应式:C2H8N2+4H2O+16e-=2CO2+N2+16H+
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
下列叙述中能肯定A金属比B金属金属性强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A原子的电子层数比B原子的电子层数多
C. 1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D. 常温时,A能从水中置换出氢,而B不能
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:简答题
周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的价层电子排布式为__________。b、c、d三种元素中第一电离能最大的是_____(填元素名称);
(2)a和其他四种元素形成的二元共价化合物分子中既含有极性共价键、又含有非极性共价键的化合物是 __________(填化学式,写出两种);
(3)这五种元素的原子中有的能形成含氧酸,三角锥结构的酸是__________(填化学式);酸根是___________
(4)写出由这五种元素中的某些原子构成的,与3个c原子构成的分子互为等电子体的微粒_____(填化学式,写出两种)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.用Pt电极电解少量的CuC12溶液:2H2O+Cu2++2Cl- 通电 H2↑+C12↑+Cu(OH)2↓
B.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
C.酸性高锰酸钾溶液中滴加H2O2溶液4MnO4- + 4H2O2 + 12H+ = 4Mn2+ + 7O2↑+ 10H2O
D.向磁性氧化铁中加入氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:推断题
已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。含E元素的硫酸盐溶液是制备波尔多液的原料之一。按要求回答下列问题:
(1)五种元素中第一电离能最大的是__________,电负性最大的是__________。(以上两空均填元素名称)
(2)基态E原子的价电子排布式为__________;E元素所在周期中基态原子的成单电子数最多的元素是__________(填元素符号)
(3)M分子中B原子的轨道杂化类型为__________,M分子中两种键角的大小关系是__________。(用∠XYZ表示,X、Y、Z代表元素符号)
(4)C3-的空间构型为__________;化合物CA3的沸点比BA4的高,其主要原因是__________。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有__________。(填代号)
A.离子键 B.σ键 C.非极性共价健 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为__________。已知晶胞中最近两个D原子间距离为anm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)

查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
化学与生活、人类生产、社会可持续发展密切相关,下列有关说法错误的是( )
A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料
C. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体
D. 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
X、Y、Z、W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17.下列说法正确的是 ( )
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. 元素的原子半径由小到大的顺序为r(Y)<r(Z)
C. X与其余三种元素之间形成的核外电子总数为 10的微粒只有4种
10的微粒只有4种
D. H2Z的熔点比H2W高,是因为H2Z分子内存在氢键
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:填空题
氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,
制备氯化亚铜的生产工艺如下:
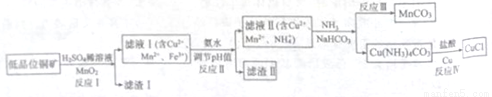
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:选择题
25℃时,0. molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A. W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B. pH=14的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D. pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com