
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
科目:高中化学 来源: 题型:
【题目】一定条件下,反应室(容积恒定为2 L)中有反应:A(g)+2B(g)=C(g)。
(1)能说明上述反应达到平衡状态的是________(填字母,下同)。
A.反应中A与B的物质的量浓度之比为1∶2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2v正(A)=v逆(B)
(2)1 mol A(g)与2 mol B(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如图所示:
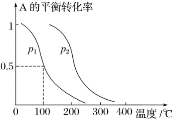
①p1________(填“<”、“>”或“=”,下同)p2,正反应的ΔH________0。
②下列措施中一定能使c(C)/c(A)增大的是________。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(3)100 ℃时将1 mol A和2 mol B通入反应室,保持温度不变,10 min末C(g)的浓度为0.05 mol·L-1,则10 min末B的转化率为________,此时v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)![]() 3Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4molY和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法不正确的是
3Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4molY和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法不正确的是
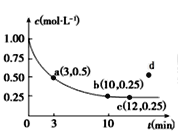
A.若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度等于0.125mol/L
B.a点正反应速率大于逆反应速率
C.反应达平衡时,降低温度不能实现c到d的转化
D.该条件下,反应达平衡时,平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇(CH3CH2OH)是一种重要的有机物
(1)根据乙醇分子式和可能结构推测,1mol乙醇与足量钠反应,产生氢气的物质的量可能是________________mol。
(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,该反应的化学方程式是________________________________,乙醇的官能团是_______________。
(3)用如图装置实验,干冷烧杯罩在火焰上,有无色液体产生。
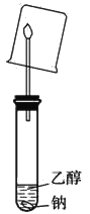
能否据此说明一定有氢气产生,判断及简述理由是_________________________。
(4)乙醇与钠反应比水与钠反应平缓的多,原因是_______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院上海硅酸盐研究所开发出基于硫化银(![]() )柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的
)柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的![]() 薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
(1)Ag的核外电子排布式是![]() ,则Ag在元素周期表中的位置是____。下列关于
,则Ag在元素周期表中的位置是____。下列关于![]() 的电子排布式书写正确的是____(填标号)。
的电子排布式书写正确的是____(填标号)。
a.![]() b.
b.![]() c.
c.![]()
(2)乙硫醇(![]() )是一种含硫有机物,和醋酸银可发生下列反应:
)是一种含硫有机物,和醋酸银可发生下列反应:![]()
乙硫醇中S原子的杂化类型是______。乙酸中羧基碳原子的杂化类型是_____,乙酸中含有的![]() 键数:
键数:![]() 键数=_____。
键数=_____。
(3)Cu与Ag为同族元素,熔点:Cu________Ag(填“>”或“<”),原因是________________。
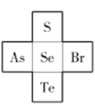
(4)S、Se、Te在元素周期表中与其他元素的位置关系如下图所示,则Te、As、Se、Br的第一电离能由大到小的顺序为________,![]() 的空间构型为________。
的空间构型为________。
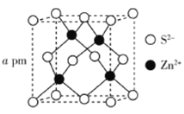
(5)ZnS的晶胞结构如下图所示,其密度为![]() ,晶胞边长
,晶胞边长![]() ________pm(用含
________pm(用含![]() 、
、![]() 的代数式表示,
的代数式表示,![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,现象及得出的结论正确的是()
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 甲基使苯环的活性增强 |
B |
| 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国医药学是一个伟大的宝库。古代制取下列药物过程中未发生氧化还原反应的是( )
A | 《本草纲目》:制取“玄明粉”( | 以芒硝于风日中消尽水气,自成轻飘白粉也 |
B | 《通玄秘术》:制取“华盖丹”(醋酸铅) | 以铁筋穿作窍,以绳子穿之;用净瓷瓮子盛米醋1斗,将铅片子悬排于瓮子口…… |
C | 《本草蒙筌》:制取“灵砂”(硫化汞) | 水银一两,硫黄六铢,先炒作青砂头,后入水火炉抽之…… |
D | 《本草图经》:制取“铁华粉”(醋酸亚铁) | 以铁拍做段片,置醋糟中,积久衣生…… |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用![]() 处理
处理![]() 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用![]() 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
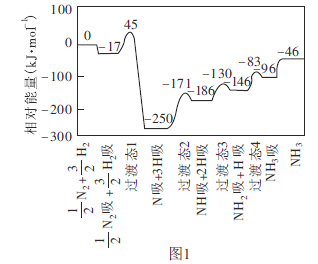
①该反应历程中正反应的最大活化能为________![]() 。
。
②合成氨反应的热化学方程式为_________________。
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中![]() 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的![]() ________N点的
________N点的![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
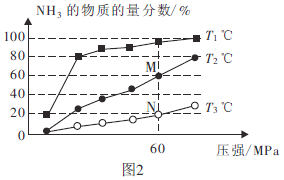
②![]() ℃时,将
℃时,将![]()
![]() 和
和![]()
![]() 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________![]() (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
(3)①用次氯酸钠除去氨氮(以![]() 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。
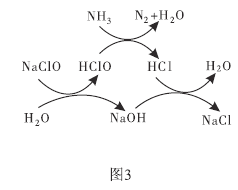
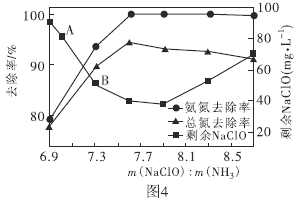
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随![]() 的变化情况如图4所示。当
的变化情况如图4所示。当![]() 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将![]() 转化为
转化为![]() ,部分装置如图5所示。
,部分装置如图5所示。
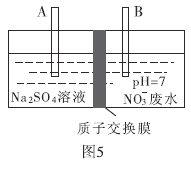
①B电极的电极反应式是________.
②常温下,除去10L废水中的![]()
![]() 后,最终废水的
后,最终废水的![]() ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com