
【题目】室温下,反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为10-8 。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH-的平衡常数为10-8 。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.2mol/L 氨水:c(NH3H2O)>c(NH4+)>c(OH-)>c(H+)
B.0.6 mol/L氨水和0.2 mol/L![]() 溶液等体积混合:c(NH3H2O)+c(CO32-)+c(OH-)=0.3mol/L+2c(H2CO3)+c(H+)
溶液等体积混合:c(NH3H2O)+c(CO32-)+c(OH-)=0.3mol/L+2c(H2CO3)+c(H+)
C.0.2 mol/L氨水和0.2 mol/L![]() 液等体积混合:c(NH4+)+c(NH3H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
液等体积混合:c(NH4+)+c(NH3H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.0.2mol/L NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3H2O)
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】正确表示下列反应的离子反应方程式为
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2═2 Fe3++2 Br2+6Cl﹣
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:![]()
C.![]() 稀溶液与过量的KOH溶液反应:
稀溶液与过量的KOH溶液反应:![]()
D.醋酸除去水垢:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:
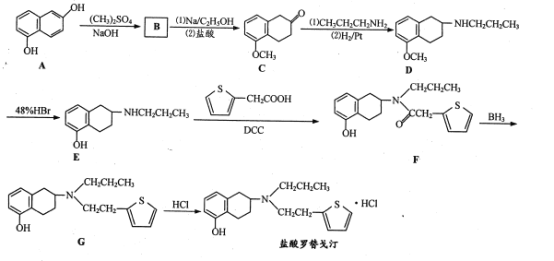
(1)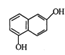 、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
(2)D→E的反应类型是_______。
(3)B的分子式为C12H12O2,写出B的结构简式;____ 。
(4)C的一种同分异构体X同时满足下列条件,写出X的结构简式:_______。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:![]()
![]() R3COOH+
R3COOH+![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备 的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5-羟色胺,最早是从血清中发现的,又名血清素。广泛存在于哺乳动物组织中,是一种抑制性神经递质。下列有关说法正确的是
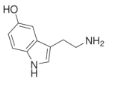
已知:五元氮杂环上的原子在同一平面上。
A.一定共平面的 C 原子有 9 个
B.苯环上的一氯代物有 2 种
C.分子中含有四种官能团,可发生加成、消去、中和等反应
D.5-羟色胺的分子式为 C10H10N2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:
主反应 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(乙醚的制备)
实验装置如图所示(夹持装置和加热装置略)

(1)仪器a是_____(写名称);仪器b应更换为下列的 ___(填字母)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为_____(填字母),取出乙醚后立即密闭保存。
a.组装实验仪器
b.加入12mL浓硫酸和少量乙醇的混合物
c.检查装置气密性
d.熄灭酒精灯
e.点燃酒精灯
f.通冷却水
g.控制滴加乙醇的速率与产物馏出的速率相等
h.弃去前馏分
i.拆除装置
(3)加热后发现仪器a中没有添加碎瓷片,处理方法是_____;若滴入乙醇的速率显著超过产物馏出的速率,则反应速率会降低,可能的原因是 ____。
(乙醚的提纯)
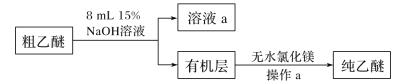
(4)用15%NaOH溶液洗涤粗乙醚的原因是____________;无水氯化镁的作用是_____。
(5)操作a的名称是____;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管接室外相同,均为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(![]() )能添加在牙膏、口香糖中以增强香气。下列关于G的说法错误的是( )
)能添加在牙膏、口香糖中以增强香气。下列关于G的说法错误的是( )
A.分子式为C11H14O
B.一氯代物有8种(不考虑立体异构)
C.所有碳原子可能在同一平面上
D.能发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列计算(注意单位)
(1)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(2)在标准状况下,0.5 mol任何气体的体积都约为________ L。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是________。
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为________。
(5)0.3 mol NH3分子中所含氢原子数与____________个H2O分子中所含氢原子数相等。
(6)含0.4 mol Al3+的Al2(SO4)3中所含的SO![]() 的物质的量是________mol。
的物质的量是________mol。
(7)2.3 g Na中含电子的物质的量为___________mol,在跟足量水反应中失去电子的物质的量为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com