
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3三溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为3︰2︰1,则上述三溶液的体积比为( )
A.1︰1︰1 B.3︰2︰1 C.6︰3︰2 D.9︰3︰1
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
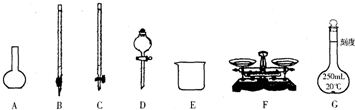
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00 mL溶液;
③量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
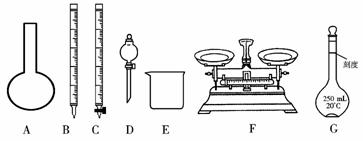
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和____________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为____________ mL,量取该体积的浓H2SO4用到量筒规格是____________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
□Fe2++□ClO2□□=□Fe3++□Cl-+□H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成____________(填“偏大”“偏小”或“不影响”),等物质的量的ClO2与Cl2的氧化效率之比为____________。
(4)第⑥步的操作中,将沉淀物转移到____________(填仪器名称)中加热,冷却至室温,称量其质量为m1 g,再次加热并冷却至室温称量其质量为m2 g,若m1与m2差值较大,接下来的操作应当是____________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会____________(填“偏大”“偏小”或“不影响”);若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为____________(列出算式,不需化简)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省嘉兴市高三教学测试(二)理综化学试卷(解析版) 题型:填空题
A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强。X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同。A与B等物质的量反应生成D和一种气体单质;C受热分解得到Y、D和X;B与C反应生成D和X。E由两种元素组成,式量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g·L-1。
(1)A的化学式是??????? ????? 。Y的电子式是?????? ??????? 。
(2)X的沸点比同主族同类型物质要高,原因是? ???????????? ? 。
(3)写出E与足量盐酸反应的化学方程式???????????
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式???????????? ?????? 。
(5)A的一个重要应用是根据2A →P +H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,当它完全沉淀时,溶液中Ca2+的物质的量浓度至少为????????? 。
(沉淀Ksp=2.3×10-9,当溶液中离子浓度≤10-5mol·L-1,即可认为完全沉淀)
(6)实验室常用P与足量HCl反应所得的有机物在浓硫酸条件下共热分解制某还原性气体,设计实验证明分解产物中还原性气体的存在?????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com