
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示:

下列说法不正确的是( )。
A.氨可用作制冷剂
B.铵态氮肥一般不能与碱性化肥混合使用
C.硝酸可用于制化肥、农药、炸药、染料、盐类等
D.某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
对于难溶盐MX,其饱和溶液中M+和X-的物质的量 浓度之间的关系类似于[H+]·[OH-]=Kw,存在等式[M+]·[X-]=Ksp。现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是(
浓度之间的关系类似于[H+]·[OH-]=Kw,存在等式[M+]·[X-]=Ksp。现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是(  )
)
①20 mL 0.01 mol·L-1 KCl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1 HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
请回答下列问题:
(1)传统中药的砷剂俗称“砒霜”,请回答下列问题:
①基态砷原子的价层电子排布式为 ,砷与硒的第一电离能较大的是 .
②砷酸(H3AsO4)是一种三元中强酸,根据价层电子对互斥理论推测AsO43﹣的空间构型为 .
(2)下列现象和应用与电子跃迁无关的是 .
A.激光 B.焰色反应 C.原子光谱 D.燃烧放热 E.石墨导电
(3)CS2分子的键角是 .
(4)A、B均为短周期金属元素.依据下表数据和已学知识,
| 电离能/KJ•mol﹣1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
判断金属B的价电子电子排布式
(5)G为第四周期未成对电子数最多的元素。写出G基态原子的价电子排布式 ;其基态原子有 种能量不同的电子.与该元素同周期的基态原子中最外层电子数与铬原子相同的元素有 (填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
对右图两种化合物的结构或性质描述正确的是( )。
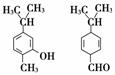
A.不是同分异构体
B.分子中共平面的碳原子数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图所示(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )。
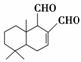
A.Br2的CCl4溶液 B.Ag(NH3)2OH溶液
C.HBr D.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是(双选)( )。
A.氯气的性质很活泼,与氢气混合后立即发生爆炸
B.实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
C.新制氯水的氧化性强于久置氯水
D.除去Cl2气体中的HCl,可将气体通入饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
目前钢铁是日常生活中使用最广泛的金属,下列关于铁的一些说法正确的是( )。
A.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
D.Fe3O4溶解于盐酸既有FeCl2又有FeCl3生成,故Fe3O4属于混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
设C(s)+CO2(g)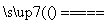 2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
 2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极按如图中装置完成实验,其中A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A烧杯溶液中NaOH的质量分数为10.23%。试回答下列问题:
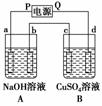
(1)电源的P极为________极。
(2)b极产生气体的体积为________L(标准状况)。
(3)c极上析出沉淀的质量为________g。
(4)d极上所发生的电极反应为__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com