
对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,能说明反应达到化学平衡状态的是( )
A.断开1个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1:3:2
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
肼是重要的化工原料。某探究小组利用下
列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液。(实验装置如右图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。

(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓
度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实验方案。
。
实验二: 制取水合肼。(实验装置如右图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。
加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物A的相对分子质量为153,A有如下的性质:
Ⅰ.取A的溶液少许,加入NaHCO3溶液,有气体放出。
Ⅱ.另取A的溶液,向其中加入足量的NaOH溶液,加热反应一段时间后,再加入过量HNO3酸化的AgNO3溶液,有淡黄色沉淀生成。
A有如下的转化:
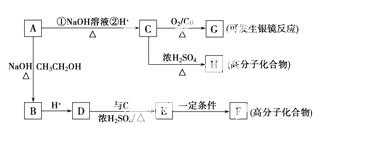
请填空:
(1)A物质的结构简式为_____________________________________________。
(2)C—→G的反应类型为_______________________________________;
A—→B的反应类型为___________________________________________。
(3)写出与C具有相同官能团的同分异构体的结构简式:
_____________________________________________________________;
G与过量的银氨溶液反应,每生成2.16 g Ag,消耗G的物质的量是________ mol。
(4)写出下列反应的化学方程式:
D—→E______________________________________________________;
C—→H__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
混凝土强度大,常常用来建造高楼大厦、桥梁涵洞、高速公路等,在现代社会中发挥着举足轻重的作用,下面是钢筋混凝土的主要成分的是( )
A.水泥、沙子和钢筋 B.水泥、沙子、碎石和钢筋
C.水泥、碎石和钢筋 D.水泥、沙子和碎石
查看答案和解析>>
科目:高中化学 来源: 题型:
请将以下材料与应用领域建立相应的连线:
A.铝合金(金属材料) a.航天飞机隔热瓦
B.碳纤维增强的树脂基复合材料 b.制门窗框、球拍
C.碳纤维增强的金属基复合材料 c.制飞机机翼
D.Si3N4陶瓷为基体的碳 d.制球拍等体育用品
纤维增强复合材料 及人体韧带
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)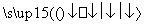 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = kJ·mol-1。
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K≈ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1,简述该设想能否实现的依据: 。
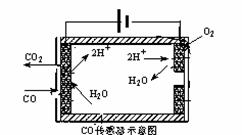
 ②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
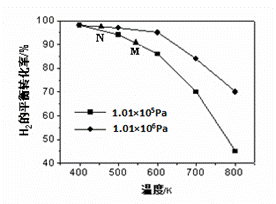
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
①该反应的△H 0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.5 L 1 mol/L 氯化铁溶液和0.2 L 2 mol/L氯化钾溶液中,氯离子数之比是[ ]
A.5:4 B.3:2 C.5:2 D.15:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com