
����Ŀ��ij��ѧ��ȤС��ͬѧչ����Ư����������(NaClO2)���о���
ʵ����. ��ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��3H2O������38��ʱ�����ľ�����NaClO2������60 ��ʱNaClO2�ֽ��NaClO3��NaCl����������ͼ��ʾװ�ý���ʵ�顣

(1) װ�����в���ClO2����Ļ�ѧ����ʽΪ ��
װ�������Ʊ�NaClO2�Ļ�ѧ����ʽΪ ��
(2) װ������������ ��
(3) ��װ������Ӧ�����Һ���NaClO2����IJ����������£�
����ѹ��55�������ᾧ�������ȹ��ˣ��� ��������60 ������õ���Ʒ��
ʵ��II. �ⶨij����������Ʒ�Ĵ���
�������ʵ�鷽����������ʵ�飺
����ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ(��֪��ClO2+4I+4H+==2H2O+2I2+Cl)�������û��Һ���250 mL������Һ��
����ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2+2S2O32=2I+S4O62)��
(4) �ﵽ�ζ��յ�ʱ������Ϊ ��
(5) ����Ʒ��NaClO2����������Ϊ (�ú�m��c��V�Ĵ���ʽ��ʾ)��
(6) �ڵζ�������ȷ���������£���ʵ���ý��ƫ�ߣ�ԭ�������ӷ���ʽ��ʾΪ ��
���𰸡�
(1)2NaClO3+Na2SO3+H2SO4==2ClO2��+2Na2SO4+H2O
2NaOH+2ClO2+H2O2==2NaClO2+2H2O+O2
(2)��ֹ����
(3)��38��60������ˮϴ��
(4)��Һ����ɫ��Ϊ��ɫ����30s�ڲ���ɫ
(5)![]() %(6)4I-+O2+4H+==2I2+2H2O
%(6)4I-+O2+4H+==2I2+2H2O
��������
�����������1���������ƾ��л�ԭ�����ڷ�Ӧ������ԭ����װ�����в���ClO2�ķ�Ӧ����������������Һ��������������Ϊ����������������ԭΪ������������Ӧ�Ļ�ѧ����ʽΪ��2NaClO3+Na2SO3+H2SO4=2ClO2��+2Na2SO4+H2O��װ������Ӧ�����Һ���NaClO2��������װ����������NaClO2��ClԪ�صĻ��ϼ۽�����˫��ˮӦ���ֻ�ԭ�������������������ԭ���غ��֪������ˮ��������ƽ��ʽΪ��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2����2��װ�����ǰ�ȫƿ�ܷ�ֹ�������ʴ�Ϊ����ֹ��������3������Һ����ȡ������һ����������ᾧ�����ˡ�ϴ�ӡ�����ķ�����Ϊ��ֹ��������NaClO2��3H2O��Ӧ���ȹ���������Ŀ��Ϣ��֪��Ӧ�����¶�38����60������ϴ��������60���������ʴ�Ϊ����38����60����ˮϴ������4���������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Na2S2O3��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ����ʴ�Ϊ���μ����һ��Na2S2O3��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ�����5������Ʒ��NaClO2����������Ϊa������
NaClO2��2I2��4S2O32-
90.5g 4mol
mag c mol��L-1��V��10-3L��![]() ��
��
����90.5g��mag=4mol��c mol��L-1��V��10-3L��![]() ��
��
���a=![]() %=
%=![]() %���ʴ�Ϊ��
%���ʴ�Ϊ��![]() %��
%��
��6��ʵ���ý��ƫ����˵���ζ����ĵ�Na2S2O3��Һ���ƫ������Һ�е�ĺ���ƫ����Ӧ�����ɵĵ����ӱ���������Ϊ����ͬʱ����ˮ����Ӧ���ӷ���ʽΪ4I-+O2+4H+=2I2+2H2O��
�ʴ�Ϊ��4I-+O2+4H+=2I2+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������ϵ�������أ�����˵���������
A. �մ��ǹ����β�Ʒ
B. �����ǿ������ƾ�ҵ
C. ֽ����Ҫ�ɷ�Ϊ��ά��
D. ���������Ҫ�ɷ�̼������ڼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����������Ļ�ѧ�����У�˵������ȷ���ǣ� ��
A. ̼�������ĺ���Ԫ�أ������ڻ�ϸ���к������
B. �ֽ�֬���ȷֽ��������������Ҫ���ĸ��������
C. �����ë�����⡢ͷ������Ҫ�ɷ��ǵ����ʣ���Щ�����ʳ�Ϊ�ṹ����
D. ���ǡ������ʡ�����������γɹ�����Ҫ��ȥˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺϻ�����һ�����͡���Ч�������;�ˮ�����䵥����Һ̬�ļ�ʽ�Ȼ���Al2(OH)nCl6��n����ʵ�����������Һˮ���������Ʊ���ʽ�Ȼ��������Ʊ�ԭ��Ϊ�ֲ��㡢�۸����ĸ���������ѧ���Ϊ��Al2O3��25%��34%����SiO2��40%��50%����Fe2O3��0.5%��3.0%���Լ��������ʺ�ˮ�֡���֪�������ж��ֲ�ͬ�Ľṹ����ѧ����Ҳ�в��죬��һ�������¿��ת�����������е��������������ᡣ�Ʊ���ʽ�Ȼ�����ʵ���������£�
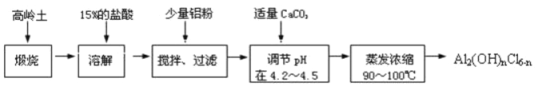
��������ͼ�ش��������⣺
��1�������ա���Ŀ���� ��
��2��������������15%��������Ҫ200ml30%��Ũ���ᣨ�ܶ�ԼΪ1.15g��cm��3���� g����ˮ�������õ��������� ��
��3�����ܽ⡱�����з�����Ӧ�����ӷ���ʽΪ ��
��4�����������۵���Ҫ������ ��
��5��������Ũ�����豣���¶���90��100�棬�����¶ȵ�ʵ�鷽���� ��
��6�����ܽ���̸�Ϊ����һ��Ũ�ȵ�����������Һ��������Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������6��������������ص��л��
��![]() �����ܼ�����
�����ܼ�����![]() ���ϳ���ԭ�ϣ���CH3CH2CH2CH2OH����ȡ����
���ϳ���ԭ�ϣ���CH3CH2CH2CH2OH����ȡ����
��CH2=CH��CH=CH2���ϳ���ԭ�ϣ���![]() ���ϣ�
���ϣ�
��![]() ��ֲ�������̼��أ�
��ֲ�������̼��أ�
��ش�
��1������������ǣ�����ţ� ��
��2����ڻ�Ϊͬϵ����ǣ�����ţ� ��
��3����ۻ�Ϊͬ���칹����ǣ�����ţ� ��
��4����ϵͳ����������������������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڲⶨϡ�������������ϡ��Һ�кͷ�Ӧ��Ӧ�ȵ�ʵ����û��ʹ�õ�����(����)
�ٴ�С�ձ���������ƿ������Ͳ���ܻ��β��������
���Թܡ����¶ȼơ���������������ƽ
A. �٢ڢޢ� B. �ڢݢߢ�
C. �ڢۢߢ� D. �ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ճ�������������Ҫ��Ӧ�á�����������ȷ����( )
A�����л��������ܻ������������ö�����������ͨ�����˷�����ȥ
B�����������������ڽ��ػ����������������ָ��£������������ǽ�������
C��SiCl4��ս���г�����������������Ϊ��ˮ��ʱ���ɰ�ɫ����
D����������������������ЧӦ�������⻯ѧ���������γɶ��뵪��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������a����b(NO3)2��Һ�з������·�Ӧ��a��b2��===a2����b��������˵����ȷ���ǣ� ��
A�������£�a��b������ˮ������Ӧ
B��a��b�õ������Ӳ���ϡH2SO4�У����γ�ԭ�����b������H2�ų�
C��a��b�õ������Ӳ���b(NO3)2��Һ��һ������ԭ���
D���ö��Ե缫���a(NO3)2��b(NO3)2�Ļ��Һ��������������b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪�缫���ϣ�����ͭ������ʯī��п�������������Һ��CuCl2��Һ��Fe2��SO4��3��Һ�����ᣮ��Ҫ��ش��������⣺
�ٵ繤�����Ϲ涨�����ܰ�ͭ���ߺ�������������һ��ʹ�ã����õ绯ѧ֪ʶ˵��ԭ�� ��
�����缫����ѡͭ��ʯī���������Һѡ��������Һ����ӵ��ߣ��ܷ�ԭ��أ� �� ����ܡ����ܡ��������ܣ���д���缫��Ӧʽ�� ��
������ʯī���缫�����1L0.1mol/L���ᣬ��ת��0.5mol����ʱ�������õ����������������Ϊ L��
��2������Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч�ʵ��ص㣮��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺
��д������ȼ�ϵ�ع���ʱ�����缫��Ӧ����ʽ�� ��
�����������ȼ�ϵ��ÿת��0.1mol���ӣ����ı�״�������� ��
��������ȼ�ϵ�ظĽ�Ϊֱ���Լ��������Ϊԭ�Ͻ��й���ʱ��������ӦʽΪ ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com