
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目。
(1)方案Ⅰ:有人提出将大小相等的铁片和铜片同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为___。
(2)方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出负极的电极反应式___。

(3)方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案及现象(与方案Ⅰ、Ⅱ不能雷同):___。
【答案】Fe+2H+=Fe2++H2↑ Fe-2e-=Fe2+;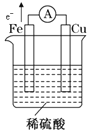 将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的
将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的
【解析】
金属活动性可利用金属与酸的反应、电化学反应、置换反应等原理进行验证。
(1)铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑;
(2)负极上铁失电子生成二价铁离子,发生氧化反应,电极反应式为Fe-2e-=Fe2+;用铁、铜作电极,稀硫酸作电解质溶液设计原电池,铁的金属性比铜强,所以铁作负极,铜作正极,电子从负极沿导线流向正极, ;
;
(3)根据铁和铜的置换反应设计,设计方法如下:将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的;反应原理为:铁和铜离子发生氧化还原反应生成铜和二价铁离子。


科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-
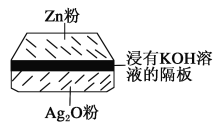
根据上述反应式,完成下列填空。
(1)下列叙述正确的是______。
A.在使用过程中,电解质溶液中的KOH被不断消耗,pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(2)写出电池的总反应式:___________。
(3)使用时,负极区的pH____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
查阅资料:CuCl22H2O ![]() CuCl2
CuCl2 ![]() CuCl+Cl2;CuCl22H2O
CuCl+Cl2;CuCl22H2O![]() Cu2(OH)2Cl2
Cu2(OH)2Cl2![]() CuO
CuO
(实验探究)该小组用下图所示装置进行实验(夹持仪器略)。
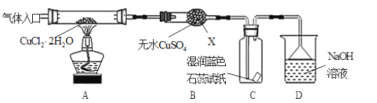
请回答下列问题:
(1)仪器X的名称是___;装置D中倒扣的三角漏斗的作用是_____;
(2)实验操作的先后顺序是a→____→____→____→e (填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是____;
(4)装置D中发生的氧化还原反应的离子方程式是_____;
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息
①若杂质是CuCl2,则产生的原因是____;
②若杂质是CuO,则产生的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某化学兴趣小组测定其中NH4HCO3的含量。小组的同学设计用在混合物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+—SO42-+Mn2++H2O)回答以下问题:
(1)化学小组要紧选用了以下药品和仪器进行实验(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
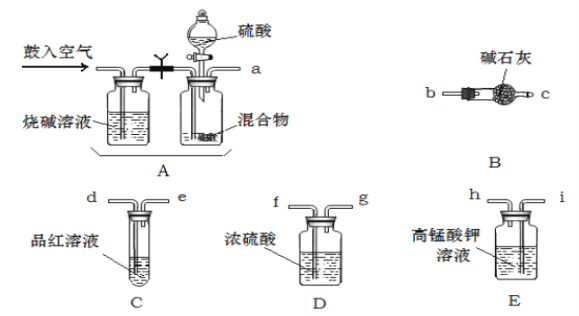
请按气流由左向右的方向,仪器连接顺序是〔填仪器的接口字母a、b...)a→_______f→g→_______。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是;加酸后A装置再次鼓入空气的作用是_______。
(3)E装置的作用是:_______。
(4)实验中,假设C试管中溶液褪色,那么测定结果可能会偏_______,为了确保实验中C试管中溶液不褪色,假设取样品的质量为mg,实验前E中所装amol·L-1的KMnO4溶液体积〔V〕应多于______mL;
(5)假设混合物样品质量为9.875g,充分作用后碱石灰增重4.4g,那么混合物中NH4HCO3的质量分数为_______。
(6)从定量测定的准确性的角度考虑,该套装置还应作进一步的改进,改进的措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2L的密闭容器中,将2molM气体和3molN气体混合,发生下列反应:2M(g) + 3N(g)![]() xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
A. X值为2 B. 容器内压强不变
C. 平衡时N的浓度为0.6mol/L D. M的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机A是衡量一个国家石油化学工业的发展水平,D的分子式为C2H5Cl,C是一种常见的高分化合物。请回答下列问题:
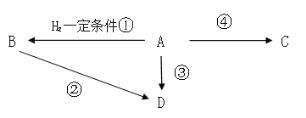
(1)写出A的结构式___;
(2)写出②的方程式___;途径②、③都可以得到D,更合理的是途径___,理由是___;
(3)写出区别A、B两种物质的一种试剂___;
(4)写出④的方程式___;
(5)体育比赛中,当运动员扭伤或肌肉挫伤时,队医随即对准运动员的受伤处喷射液体D(沸点12.27℃)进入局部冷冻麻醉处理,原理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2()3)制备二硫化钨的工艺流程如图所示,下列说法正确的是
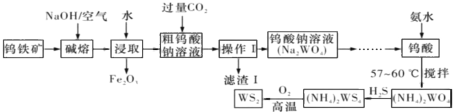
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4NaWO3+4H2O
2Fe2O3+4NaWO3+4H2O
C.生成二硫化钨的化学方程式为(NH4)2WS4+3O2![]() 2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com