
| A. | ①②③ | B. | ①②③④ | C. | ①②④ | D. | ①③④ |
分析 ①元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
②元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
③同周期从左到右原子半径依次减小;
④元素的非金属性越强,对应阴离子的还原性越弱.
解答 解:①非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:HClO4>HBrO4>HIO4,故①正确;
②金属性:Ca>Mg>Be,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:Ca(OH)2>Mg(OH)2>Be(OH)2,故②正确;
③同周期从左到右原子半径依次减小,则原子半径:P>S>Cl,故③正确;
④非金属性F>O>N,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HF>H2O>NH3,故④错误.
故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.


 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
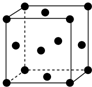 (1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.
(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | S | C. | Al | D. | O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时正极反应为:FeO${\;}_{4}^{2-}$+4H2O+3e-═Fe(OH)3+5OH- | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有甲烷 | B. | 可能有乙烯 | ||
| C. | 一定不含有乙烷 | D. | 一定含有乙烯,不一定含有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 | |
| B. | S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g),△H1; C(s)+O2(g)=CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com