
| A. | 1分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ | |
| C. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ | |
| D. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ |
分析 由H2(g)+Cl2(g)=2HCl(g)△H(298K)=-184.6kJ•mol-1可知,在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ,以此来解答.
解答 解:A.化学计量数表示物质的量,不表示分子个数,故A错误;
B.没有指出温度、压强,故B错误;
C.由H2(g)+Cl2(g)=2HCl(g)△H(298K)=-184.6kJ•mol-1可知,在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ,故C正确;
D.△H为负,该反应为放热反应,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、热化学方程式的意义为解答的关键,侧重分析与应用能力的考查,注意反应的条件、化学计量数的意义,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:实验题
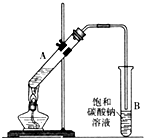 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol (燃烧热) | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反应热) | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3△H1+2△H2-△H3 | B. | △H1+△H2-△H3 | C. | 3△H1+△H2+△H3 | D. | 3△H1+△H2-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
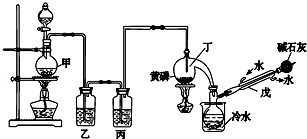
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
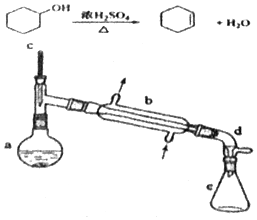 分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:
分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4 L | B. | 11.2 L | C. | 14.0 L | D. | 16.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分别加入碘化钾溶液,观察颜色变化 | |
| B. | 分别加热,观察是否生成沉淀 | |
| C. | 分别滴加浓硝酸 | |
| D. | 分别灼烧,闻味道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com