
【题目】糖类、油脂和蛋白质都是人体基本营养物质。请回答下列问题:
(1)在试管中加入![]() 淀粉和
淀粉和![]() 20%的
20%的![]() 溶液,加热3~4min,然后用碱液中和试管中的
溶液,加热3~4min,然后用碱液中和试管中的![]() 溶液。
溶液。
①淀粉完全水解生成的有机物的分子为___________________________。
②若要检验淀粉已经发生了水解,可取少量上述溶液并向其中加入___________________________(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液,向其中加入几滴碘水,可观察到___________________________。
(2)油脂在人体内通过水解生成___________________________和丙三醇,再氧化分解,为人体提供能量。
(3)为了鉴别某白色纺织品的成分是蚕丝还是“人造丝”,通常选用的方法是_____________(填序号)。
A.滴加稀盐酸 B.滴加浓硫酸 C.滴加酒精 D.在火焰上灼烧
【答案】![]() 银氨溶液或新制的氢氧化铜悬浊液 溶液变蓝 高级脂肪酸 D
银氨溶液或新制的氢氧化铜悬浊液 溶液变蓝 高级脂肪酸 D
【解析】
(1)淀粉完全水解生成葡萄糖,葡萄糖可以用银氨溶液或者新制氢氧化铜悬浊液检验,淀粉可以用碘水检验;
(2)油脂在人体内水解的最终产物为高级脂肪酸和丙三醇;
(3)蚕丝的主要成分是蛋白质,“人造丝”的主要成分上纤维素。
(1)淀粉水解的最终产物为葡萄糖,分子式为![]() ,银氨溶液或新制
,银氨溶液或新制![]() 悬浊液可检验葡萄糖,但要在碱性环境下,从而证明淀粉已发生水解,而加入碘水后溶液变蓝,说明淀粉未完全水解,故答案为:
悬浊液可检验葡萄糖,但要在碱性环境下,从而证明淀粉已发生水解,而加入碘水后溶液变蓝,说明淀粉未完全水解,故答案为:![]() ;银氨溶液或新制的氢氧化铜悬浊液;溶液变蓝;
;银氨溶液或新制的氢氧化铜悬浊液;溶液变蓝;
(2)油脂在人体内水解的最终产物为高级脂肪酸和丙三醇,故答案为:高级脂肪酸;
(3)蚕丝的主要成分是蛋白质,“人造丝”的主要成分上纤维素。鉴别蛋白质的依据主要有:蛋白质被灼烧时,有烧焦羽毛的气味(常以此来区别毛纺织品和其他纺织品),故答案为:D。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
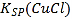
A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧钒![]() 碱式碳酸铵
碱式碳酸铵![]() 难溶于水
难溶于水![]() 化学式为
化学式为![]() ,它是制备热敏材料
,它是制备热敏材料![]() 的原料。
的原料。![]() 价钒在弱酸性条件下具有还原性。一种制备氧钒
价钒在弱酸性条件下具有还原性。一种制备氧钒![]() 碱式碳酸铵方案如下:
碱式碳酸铵方案如下:

请回答下列问题:
(1)![]() 装置盛装的试剂是________
装置盛装的试剂是________![]() 填名称
填名称![]() 。A中反应的离子方程式为________。相对分液漏斗,恒压漏斗优点是________。
。A中反应的离子方程式为________。相对分液漏斗,恒压漏斗优点是________。
(2)实验时,先关闭![]() ,打开
,打开![]() ,当________
,当________![]() 填实验现象
填实验现象![]() 时,后________
时,后________![]() 填实验操作
填实验操作![]() 。
。
(3)实验完毕后,从C装置中分离产品的操作方法是________![]() 填操作名称
填操作名称![]() 。
。
(4)测定粗产品中钒的含量。实验步骤如下:
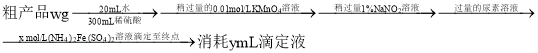
已知:滴定反应为![]()
![]() 该粗产品中钒的质量分数的表达式为________
该粗产品中钒的质量分数的表达式为________![]() 。
。
![]() 若滴定前仰视读数,终点时俯视读数,则测得结果________填“偏高”、“偏低”或“无影响”
若滴定前仰视读数,终点时俯视读数,则测得结果________填“偏高”、“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.30mol·L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg(六方最密堆积)和金属Cu(面心立方最密堆积)的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. Si-O和C-O的键能
D. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() 常用于合成洗涤剂、触媒及用作中间体。某学习小组在实验室用
常用于合成洗涤剂、触媒及用作中间体。某学习小组在实验室用![]() 与NO制备ClNO并测定其纯度,进行如下实验
与NO制备ClNO并测定其纯度,进行如下实验![]() 夹持装置略去
夹持装置略去![]() 。
。

查阅资料:
![]() 年,瑞典化学家舍勒在研究软锰矿
年,瑞典化学家舍勒在研究软锰矿![]() 主要成分是
主要成分是![]() 的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。
的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。
![]() 亚硝酰氯
亚硝酰氯![]() 的熔点为
的熔点为![]() 、沸点为
、沸点为![]() ,气态呈黄色,液态时呈红褐色。
,气态呈黄色,液态时呈红褐色。
![]() 亚硝酰氯遇水易反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。
亚硝酰氯遇水易反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ![]() 的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的______![]() 填字母标号
填字母标号![]() 为
为![]() 发生装置,该反应中被氧化与被还原物质的物质的量之比为______。
发生装置,该反应中被氧化与被还原物质的物质的量之比为______。
(2)欲收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为:![]() ______
______![]() 按气流方向填小写字母标号
按气流方向填小写字母标号![]() 。
。
Ⅱ![]() 亚硝酰氯
亚硝酰氯![]() 的制备。实验室可用下图装置制备亚硝酰氯
的制备。实验室可用下图装置制备亚硝酰氯![]() 冰盐水的温度一般在
冰盐水的温度一般在![]() :
:
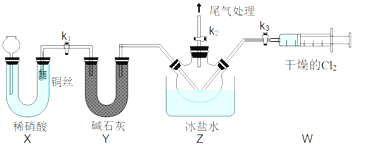
(3)实验室也可用B装置制备NO;与B装置相比,用X装置的优点为 ______。
(4)组装好实验装置后应先______,然后装入药品。一段时间后,两种气体在Z中反应的现象为______。
![]() 亚硝酰氯
亚硝酰氯![]() 纯度的测定:将所得亚硝酰氯
纯度的测定:将所得亚硝酰氯![]() 产品
产品![]() 溶于水,配制成
溶于水,配制成![]() 溶液;取出
溶液;取出![]() ,以
,以![]() 溶液为指示剂,用
溶液为指示剂,用![]() 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 ![]() 。
。![]() 已知:
已知:![]() 为砖红色固体
为砖红色固体![]()
(5)配制溶液时除使用烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器是_________;滴定终点判断的方法是____________________________。
(6)亚硝酰氯![]() 与水反应的离子方程式为_________________________。亚硝酰氯
与水反应的离子方程式为_________________________。亚硝酰氯![]() 的质量分数为_____________。
的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式见图,下列说法正确的是( )

A. 分子式为C14H16O6NBr
B. 该分子中含有两个手性碳原子
C. 不能使酸性高锰酸钾溶液褪色
D. 在一定条件下与氢氧化钠溶液反应,1 mol该有机物最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。

(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
①从平衡角度分析采用过量O2的目的是___。
②该条件下反应的平衡常数K=___。
③已知:K(300℃)>K(350℃),正反应是___(填“吸”或“放”)热反应。若反应温度升高,SO2的转化率___(填“增大”“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)___K(B)(填“大于”“等于”或“小于”,下同)。
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___乙。
②若保持乙中压强不变,向甲、乙容器中通人等质量的氦气,达到新平衡时,SO3的体积分数甲___乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H![]() B在水中的电离方程式是
B在水中的电离方程式是![]() 、HB
、HB![]() H
H![]() 。
。
![]() 的NaHB溶液显酸性,原因是________________________________。
的NaHB溶液显酸性,原因是________________________________。
![]() 在
在![]() 的Na2B溶液中,下列粒子浓度关系式正确的是________
的Na2B溶液中,下列粒子浓度关系式正确的是________![]() 填标号
填标号![]() 。
。
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com