
【题目】一块表面被氧化的铝分成两等分,若向其中一份中滴加1molL-1的NaOH溶液,向另一份中滴加x molL-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )

A. a=260
B. x=1mol/L
C. 该铝块的总质量为8.46g
D. 该铝块中氧化铝与铝单质的物质的量之比为3:20
【答案】C
【解析】分析可知,铝与盐酸、铝与氢氧化钠都是2 mol铝产生3 mol氢气;A、产生0.3mol氢气,消耗0.2mol氢氧化钠,NaOH的浓度是1mol/L,V(NaOH)=200mL,加上与氧化铝反应的60mL,求出a=260,A项正确;B、预想求出稀盐酸的浓度x,需利用2mol NaOH~1molAl2O3的关系求出n(Al2O3)=0.03mol,再根据1molAl2O3~6HCl,求出n(HCl)=0.18mol,x=1mol/L,B项正确;C、与NaOH反应的Al2O3是0.03mol,产生0.3mol氢气,需要0.2mol铝,一份铝块的质量=m(Al2O3)+m(Al)=8.46g,总质量为8.46![]() 2=16.92g,C项错误; D、根据与氢氧化钠反应的氧化铝0.03mol,与氢氧化钠反应的铝0.2mol,所以氧化铝与铝单质的物质的量之比为3:20,D项正确;答案选C。
2=16.92g,C项错误; D、根据与氢氧化钠反应的氧化铝0.03mol,与氢氧化钠反应的铝0.2mol,所以氧化铝与铝单质的物质的量之比为3:20,D项正确;答案选C。


科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是( )

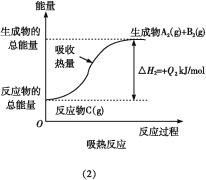
A.反应过程(1)的热化学方程式为A2(g)+B2(g)C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g)A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)

下列说法不正确的是( )
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-)≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列十种物质:①蔗糖②熔融NaCl③石墨④铜丝⑤NaOH固体⑥SO2⑦NaHSO4固体⑧K2O固体⑨液态H2SO4⑩饱和FeCl3溶液 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①NaHSO4晶体熔化时的电离方程式为______________________________。
②3 mol·L-1 NaHSO4与2 mol·L-1 Ba(OH)2溶液等体积混合,该反应总的离子方程为___________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________(填序号),反应的离子方程式为________________________________________________。
(4)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+,已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成防腐剂尼泊金丁酯(对羟基苯甲酸丁酯)、香料G (结构简式为![]() )的路线如下:
)的路线如下:

已知:
①
② ![]()
注:R、R′为烃基或H原子,R″为烃基
请回答:
(1)下列说法正确的是_________。
A.反应②F→G,既属于加成反应,又属于还原反应
B.若A→B属于加成反应,则物质X为CO
C.甲物质常温下是一种气体,难溶于水
D.上述合成路线中,只有3种物质能与FeCl3溶液发生显色反应
(2)上述方法制取的尼泊金酯中混有属于高聚物的杂质,生成该物质的化学方程式为_________。
(3)E的结构简式为_____________。
(4)写出同时符合下列条件并与化合物B互为同分异构体的有机物的结构简式____________。
①分子中含有苯环,无其它环状结构;
②1H-NMR谱表明分子中有4种氢原子:
③能与NaOH溶液反应。
(5)设计以乙烯为原料制备1-丁醇的合成路线(用流程图表示,无机试剂任选)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)
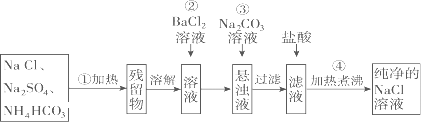
(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L1盐酸、0.55 mol·L1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L1 NaOH溶液 | 50 mL 0.5 mol·L1 HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL 0.55 mol·L1 NaOH溶液 | 50 mL 0.5 mol·L1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2t1),反应后溶液的比热容c为4.18 kJ·℃1·kg1,各物质的密度均为1 g·cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu 2(OH)3C1],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下:
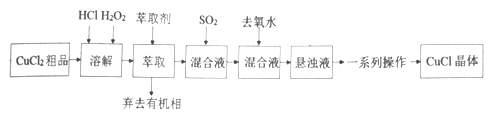
己知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)。
[CuCl3]2-(aq)。
请回答:
(1)下列叙述正确的是__________。
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇![]()
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:
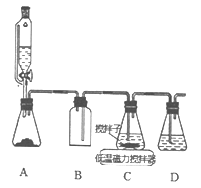
①装置D的作用是_______________。
②C中反应的离子方程式为_____________。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是________________。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、____________。
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为____________。
②产品中CuCl的纯度为__________(本实验条件下,Cl-难于被MnO4-氧化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com