


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ba2+��H+��Cl-��SO42- |
| B��K+��Ca2+��NO3-��CO32- |
| C��HCO3-��Na+��H+��NO3- |
| D��Na+��K+��CO32-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CuO����ԭ�� |
| B��CuO�������� |
| C��ͭԪ�ػ��ϼ۽��� |
| D��ͭԪ�ػ��ϼ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1 mol?L-1 NaOH��Һ��0.2 mol?L-1 CH3COOH��Һ�������Ϻ�c��CH3COOH��+c��CH3COO-��=0.1mol?L-1 |
| B�������£���CH3COONa��HCl����Һ��ϳ����Ե���Һ�У�c��Na+����c��Cl-��=c ��CH3COOH�� |
| C��pH��ȵĢ�NH4Cl���ڣ�NH4��2SO4����NH4HSO4��Һ��c��NH4+����С˳��Ϊ��=�ڣ��� |
| D��25��ʱ��pH=a��������pH=b��Ba��OH��2��Һ�������Ϻ�ǡ����ȫ��Ӧ����a+b=13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ȼ���Ļ��ͷ����Һ�к�����Ԫ��ClO3-+3NO2-+Ag+�TAgCl��+3NO3- |
| B���õ��۵⻯����Һ�ʹ��������ٵ��Σ�IO3-+5I-+6H+=3I2+3H2O |
| C����ֽ����������Fe3+��Cu2+ʱ�����γ�ְ�Ѭ��Cu2++2NH3?H2O=Cu��OH��2��+2NH4+ |
| D��������������Һ�м�������ʵ���������泥��Ʊ�Ħ����FeSO4+��NH4��2SO4+6H2O�T��NH4��2SO4?FeSO4?6H2O�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A����pH�����������ϡ�ͺ�pH�ı仯��ͼ��ʾ�������ߢ��ʾ���Ǵ����ϡ��ͼ��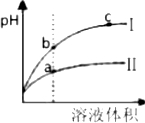 |
| B�����е����ʵ�����NaClO��NaHCO3����Һ�У�c��HClO��+c��ClO-��=c��HCO3-��+c��H2CO3��+c��CO32-�� |
| C����NH4HCO3��Һ��NH4HSO4��Һ��c��NH4+����ȣ���c��NH4HSO4����c��NH4HCO3�� |
| D����֪ij�¶���Ksp��CH3COOAg��=2.8��10-3��Ũ�Ⱦ�Ϊ0.1mol?L-1��AgNO3��Һ��CH3COONa��Һ��������һ���ܲ���CH3COOAg���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��10 mL��������Ϊ98%��H2SO4����ˮϡ����100 mL��H2SO4����������Ϊ9.8% |
| B��1molFe�������ϡHNO3��Ӧ��ת�Ƶĵ�����Ϊ2 NA |
| C����״���£�������ΪNA��CO��C2H4����������ԼΪ22.4 L������Ϊ28 g |
| D��һ���¶��£�l L 0.50 mol?L-1NH4C1��Һ��2 L0.25mol?L-1NH4C1��ҺNH4+����������Ϊ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
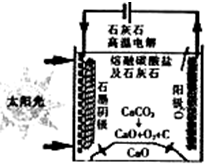 ��Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1 mol N2�����е�ԭ����ΪNA |
| B��1 mol?L-1 NaCl��Һ�к��е���������ĿΪNA |
| C����״���£�22.4 LCO������ԭ����ΪNA |
| D��24 g O2��24 g O3��������ԭ��������1.5NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com