
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 常温常压下,11.2L甲烷含有共价键数为2NA |
分析 A.铁与氯气反应生成氯化铁,但1molCl2与足量的铁反应,氯气量不足,电子转移依据氯气计算分析;
B.依据方程式:3NO2+H2O═2HNO3+NO,在反应中若有3molNO2反应,即生成1molNO时,则有2molNO2被还原,所以有2mol电子发生转移;
C.NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数即可;
D.常温常压下Vm≠22.4L/mol.
解答 解:A.1molCl2与足量Fe反应,生成$\frac{2}{3}$mol氯化铁,转移的电子数为2NA,故A错误;
B.3mol NO2与足量H2O反应,转移的电子数为2NA,故B错误;
C.NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数=$\frac{46g}{46g/mol}$×3×NA=3NA,故C正确;
D.常温常压下Vm≠22.4L/mol,无法计算甲烷的物质的量,无法计算含有共价键数目,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积的体积应用,注意氯气的强氧化性以及与变价金属反应的特点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘食盐中添加的是碘化钾 | |
| B. | 将甲醛稀溶液喷在白菜上可以保鲜 | |
| C. | 牛奶中掺入三聚氰胺可以提高蛋白质含量 | |
| D. | 人体中维持血液的pH值稳定的主要离子是HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
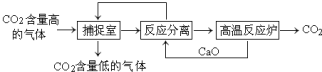 “碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).下列有关该方法的叙述中正确的是( )
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).下列有关该方法的叙述中正确的是( )| A. | 该方法的一大缺点是能耗较大 | |
| B. | 整个过程中,只有一种物质可以循环利用 | |
| C. | 该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 | |
| D. | “反应分离”环节中,分离物质的基本操作是蒸发、结晶、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Na2O2中的化学键类型有离子键和非极性共价键;
,Na2O2中的化学键类型有离子键和非极性共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能使溴水褪色 | |
| B. | 用新制的氢氧化铜浊液不能检验淀粉和纤维素是否发生了水解 | |
| C. | 油脂的水解反应,都是皂化反应 | |
| D. | 橄榄油、茶籽油和花生油等都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21.9% | B. | 43.1% | C. | 13.5mol/L | D. | 5.67mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com