
| A. | 该温度下KOH的溶解度为$\frac{2a}{1-2a%}$g | |
| B. | 原溶液的质量为3mg | |
| C. | 可以求算原溶液的物质的量浓度 | |
| D. | 保持温度不变,向原溶液中加入2a g KOH可达饱和 |
分析 A.饱和溶液的质量分数=$\frac{溶解度}{100+溶解度}$;
B.根据KOH的质量不变计算原KOH溶液的质量;
C.由V=$\frac{m}{ρ}$,c=$\frac{n}{V}$可以计算溶液物质的量浓度,但原溶液的密度不知,不能计算原溶液体积;
D.计算mg水可以溶解KOH的质量,据此判断.
解答 解:A.设该温度下KOH的溶解度为s g,则饱和溶液的质量分数=$\frac{s}{100+s}$×100%=2a%,解得s=$\frac{2a}{1-2a%}$,故A正确;
B.将溶质质量分数为a%的KOH溶液蒸发掉mg水后恢复至原温度,恰好得到质量分数为2a%的KOH饱和溶液,蒸发过程中只减少溶剂水,设原溶液的质量为xg,由溶质的质量守恒得:x×a%=(x-m)×2a%,解得x=2m,即原溶液的质量为2mg,故B错误;
C.由V=$\frac{m}{ρ}$,c=$\frac{n}{V}$可以计算溶液物质的量浓度,但原溶液的密度不知,不能计算原溶液体积,故物质的量浓度无法计算,故C错误;
D.溶解度为$\frac{200a}{100-2a}$g,则mg水可以溶解KOH的质量为$\frac{2a}{1-2a%}$g×$\frac{mg}{100g}$=$\frac{2ma}{100-2a}$g,该值不一定为2a g,故D错误,
故选:A.
点评 本题考查了溶液中溶质的质量分数、物质的量浓度的有关计算,难度不大,侧重于考查了学生的计算能力和对公式的应用能力,注意对溶解度的理解.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2g | B. | 8.6g | C. | 8g | D. | 7.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水所含的原子数目为3NA | |
| B. | 一定条件下,等物质的量甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 标准状况下,17g氨气的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=y+0.2 | B. | x=$\frac{y}{2}$ | C. | x=0.1+$\frac{y}{2}$ | D. | x=y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
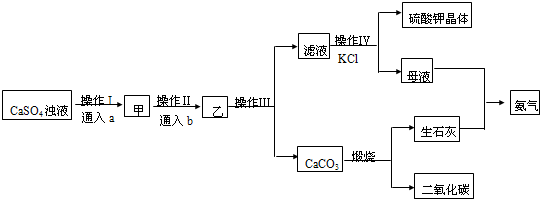
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Fe(NO3)3溶液中:Mg2+、H+、SO42-、Cl- | |
| B. | 0.1 mol•L-1 KClO溶液中:Na+、H+、Cl-、NO3- | |
| C. | 0.1 mol•L-1氨水中:Ba2+、Ag+、NH4+、NO3- | |
| D. | c(OH-)=10-13 mol•L-1的溶液中:MnO4-、Na+、Br-、CH3CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com