
| A. | 84消毒液(主要成分NaClO)与洁厕剂混合使用可能会导致中毒 | |
| B. | 晶体硅可用于光伏发电、制造芯片,硅酸钠可用于制备硅胶和木材防火剂;硅胶可用作袋装食品的干燥剂 | |
| C. | 小苏打可中和胃酸、热纯碱可除去油污 | |
| D. | 二氧化硫可广泛用于食品的增白及漂白纸浆、毛、丝、草帽辫等 |
分析 A.84消毒液(主要成分NaClO)与洁厕剂(含盐酸)发生氧化还原反应生成氯气;
B.Si为半导体材料,硅酸钠与盐酸反应生成硅酸,硅酸钠不燃烧,硅胶具有吸水性;
C.胃酸中含盐酸,与碳酸氢钠反应;热纯碱水解碱性增强可促进油污的水解;
D.二氧化硫具有漂白性,但有毒,不能应用于食品业.
解答 解:A.84消毒液(主要成分NaClO)与洁厕剂(含盐酸)发生氧化还原反应生成氯气,混合使用可能会导致中毒,故A正确;
B.Si为半导体材料,硅酸钠与盐酸反应生成硅酸,硅酸钠不燃烧,硅胶具有吸水性,则晶体硅可用于光伏发电、制造芯片,硅酸钠可用于制备硅胶和木材防火剂;硅胶可用作袋装食品的干燥剂,故B正确;
C.胃酸中含盐酸,与碳酸氢钠反应;热纯碱水解碱性增强可促进油污的水解,则小苏打可中和胃酸、热纯碱可除去油污,故C正确;
D.二氧化硫具有漂白性,但有毒,不能应用于食品业,则二氧化硫可广泛用于漂白纸浆、毛、丝、草帽辫等,但不能用于食品的增白,故D错误;
故选D.
点评 本题考查元素化合物知识,为高频考点,把握物质的性质、性质与用途的关系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 羟基(-OH)和氢氧根(OH-) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2?) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟甲基(-CH2OH)和甲氧基(CH3O-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g | B. | 33 g/mol | C. | 33 g | D. | 32 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E | F | G | H |
| 化合价 | -1 | -2 | +4、-4 | +7、-1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能从GD2溶液中置换出D单质 | |
| B. | G在CB2中燃烧生成两种化合物 | |
| C. | E元素的单质不存在同素异形体 | |
| D. | A、F、H的离子半径由大到小顺序是A>H>F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 镁原子的核电荷数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁属于非金属元素 | |
| D. | 在化学反应中,镁原子容易得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
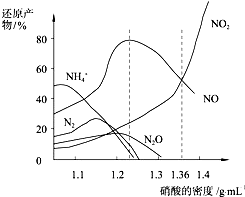
| A. | 密度小于1.1g/mL的硝酸与金属反应,还原产物主要是NH4+ | |
| B. | 当硝酸溶液的密度为1.36g/mL时,Fe与过量硝酸反应的化学方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸与金属反应,一定被还原成NO | |
| D. | 某硝酸试剂瓶的标签注明:密度1.26g/mL,质量分数50.0%;若取该试剂10mL配成1000mL溶液,所得溶液的物质的量浓度为1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com