
 æÕĘųÖŹĮæČÕ±ØÖŠÓŠŅ»ĻīÖŲŅŖ¼ģ²āÖø±źŹĒSO2µÄŗ¬Į棬½įŗĻĖłŃ§ÖŖŹ¶»Ų“šĻĀĮŠĪŹĢā£®¹¤ŅµÖĘĮņĖįµÄ¹ż³ĢÖŠ£¬SO2“ß»ÆŃõ»ÆµÄŌĄķ£ŗ2SO2£Øg£©+O2£Øg£©$?_{”÷}^{“߻ƼĮ}$2SO3£Øg£©”÷H£¼0
æÕĘųÖŹĮæČÕ±ØÖŠÓŠŅ»ĻīÖŲŅŖ¼ģ²āÖø±źŹĒSO2µÄŗ¬Į棬½įŗĻĖłŃ§ÖŖŹ¶»Ų“šĻĀĮŠĪŹĢā£®¹¤ŅµÖĘĮņĖįµÄ¹ż³ĢÖŠ£¬SO2“ß»ÆŃõ»ÆµÄŌĄķ£ŗ2SO2£Øg£©+O2£Øg£©$?_{”÷}^{“߻ƼĮ}$2SO3£Øg£©”÷H£¼0| ŹµŃ鱹ŗÅ | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
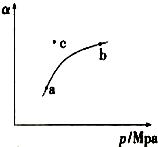
·ÖĪö £Ø1£©ĪĀ¶ČĻąĶ¬£¬Ę½ŗā³£ŹżĻąĶ¬£¬·“Ó¦2SO2£Øg£©+O2£Øg£©$?_{”÷}^{“߻ƼĮ}$2SO3£Øg£©£¬Õż·“Ó¦ŹĒĘųĢåĢå»ż¼õÉŁµÄ·“Ó¦£¬ĖłŅŌŌö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬ČżŃõ»ÆĮņµÄÅØ¶Č±ä“ó£»cµćŌŚ¶ŌÓ¦µÄŃ¹ĒæĻĀ×īÖÕŅŖ“ļĘ½ŗāדĢ¬£¬ĖłŅŌ¶žŃõ»ÆĮņµÄ×Ŗ»ÆĀŹ¼õŠ”£¬·“Ó¦ÄęĻņ½ųŠŠ£»
£Ø2£©ĻČĒó³öO2µÄ»ÆŃ§Ę½ŗāŹ±£¬ŌŁĒó³öv£ØSO2£©µÄ·“Ó¦ĖŁĀŹ£¬·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£»
øł¾ŻĘ½ŗāŅʶÆŌĄķŅŌ¼°Éś³ÉĪļµÄÅضČæÉÖŖ£ŗT1£¾T2£®
½ā“š ½ā£ŗ£Ø1£©ĪĀ¶ČĻąĶ¬£¬Ę½ŗā³£ŹżĻąĶ¬£¬·“Ó¦2SO2£Øg£©+O2£Øg£©$?_{”÷}^{“߻ƼĮ}$2SO3£Øg£©£¬Õż·“Ó¦ŹĒĘųĢåĢå»ż¼õÉŁµÄ·“Ó¦£¬ĖłŅŌŌö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬ČżŃõ»ÆĮņµÄÅØ¶Č±ä“ó£¬ĖłŅŌc£Øa£©Š”ÓŚ £Øb£©£»cµćŌŚ¶ŌÓ¦µÄŃ¹ĒæĻĀ×īÖÕŅŖ“ļĘ½ŗāדĢ¬£¬ĖłŅŌ¶žŃõ»ÆĮņµÄ×Ŗ»ÆĀŹ¼õŠ”£¬·“Ó¦ÄęĻņ½ųŠŠ£¬ĖłŅŌ¦Ō£ØÕż£©£¼¦Ō£ØÄę£©£¬¹Ź“š°øĪŖ£ŗ=£»£¼£»£¼£»
£Ø2£©¢ŁÓɱķÖŠŹż¾Ż£¬v£ØO2£©=$\frac{\frac{2mol-0.8mol}{2L}}{tmin}$=$\frac{1.2}{2t}$ mol•L-1•min-1£»
øł¾Ż·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬Ōņv£ØSO2£©=2v£ØO2£©=2”Į$\frac{1.2}{2t}$mol•L-1•min-1=$\frac{1.2}{t}$mol•L-1•min-1£¬¹Ź“š°øĪŖ£ŗ$\frac{1.2}{t}$mol•L-1•min-1 £»
¢ŚŹµŃé2ÖŠ£¬n£ØSO2£©²Ī¼Ó?£Ø4-0.4£©mol=3.6mol
n£ØO2£©ĻūŗÄ=0.5n£ØSO2£©=1.8mol
Ę½ŗāŹ±n£ØO2£©=£Ø2-1.8£©mol=0.2mol£¬¶ųŹµŃé1ÖŠn£ØO2£©=0.8mol ¶ųæŖŹ¼Ź±·“Ó¦ĪļµÄĘšŹ¼ĮæĻąµČ£¬ŹµŃé1µ½ŹµŃé2µÄ¹ż³Ģ£¬Ļąµ±ÓŚĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬øł¾ŻĘ½ŗāŅʶÆŌĄķ£¬½µĪĀÄÜŹ¹Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬¼“T1£¾T2£¬¹Ź“š°øĪŖ£ŗ·“Ó¦·ÅČČ£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāĻņ×óŅĘ¶Æ£¬·“Ó¦Īļ×Ŗ»ÆĀŹµĶ£®
µćĘĄ ±¾ĢāÉę¼°µÄÖŖŹ¶µć½Ļ¶ą£¬¹Ų¼üŅŖÕĘĪÕÓŠ¹ŲæÉÄę·“Ó¦µÄ¼ĘĖć”¢»ÆŃ§Ę½ŗāŅʶÆŌĄķŅŌ¼°Ķ¼ĻóµÄ·ÖĪöŗĶ½ā“šµČ£¬ÓŠŅ»¶ØµÄÄŃ¶Č£®


 æŚĖćĢāæر±¾©ø¾Å®¶łĶƳö°ęÉēĻµĮŠ“š°ø
æŚĖćĢāæر±¾©ø¾Å®¶łĶƳö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½¶«Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ČōCmolµÄAlCl3ČÜŅŗV1ml ¼ÓĖ®Ļ”ŹĶÖĮV2ml£¬Ļ”ŹĶŗóČÜŅŗÖŠCl-ĪļÖŹµÄĮæÅضČĪŖ
A£®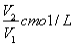 B£®
B£®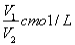 C£®
C£®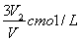 D£®
D£®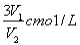
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±£³ÖĘäĖüĢõ¼ž²»±ä£¬¼ÓČėÉŁĮæW£¬Ę½ŗā½«ÄęĻņŅĘ¶Æ | |
| B£® | ±£³ÖĪĀ¶ČŗĶĢå»ż²»±ä£¬¼ÓČėÉŁĮæX£¬Õż”¢Äę·“Ó¦ĖŁĀŹ¾łŌö“ó | |
| C£® | ±£³ÖĢå»ż²»±ä£¬ÉżøßĪĀ¶Č£¬Õż·“Ó¦ĖŁĀŹŌö“ó£¬Äę·“Ó¦ĖŁĀŹ½µµĶ | |
| D£® | ±£³ÖĪĀ¶Č²»±ä£¬½«Ģå»żŃ¹ĖõŅ»°ė£¬ŠĀĘ½ŗāŹ±ĢåĻµŃ¹Ēæ±äĪŖŌĄ“µÄĮ½±¶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū | B£® | ¢Ł¢Ū¢Ü | C£® | ¢Ś¢Ū¢Ü | D£® | ¢Ł¢Ś¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | AÓėBŅ»¶Ø¶¼ŹĒĘųĢå | B£® | Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆĮĖ | ||
| C£® | ĪļÖŹBµÄÖŹĮæ·ÖŹżŌö¼ÓĮĖ | D£® | a£¼b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
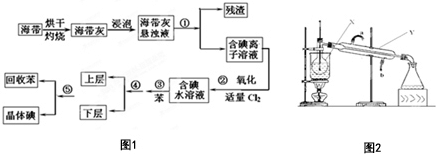 ŗ£ŃóÖ²ĪļČēŗ£“ųÖŠŗ¬ÓŠ·įø»µÄµāŌŖĖŲ£¬µāŌŖĖŲŅŌµāĄė×ӵĊĪŹ½“ęŌŚ£®ŹµŃéŹŅ“Óŗ£“ųÖŠĢįČ”µāµÄĮ÷³ĢĶ¼ČēĶ¼1£ŗ£ØŅŃÖŖ£ŗCl2+2I-ØT2Cl-+I2£©
ŗ£ŃóÖ²ĪļČēŗ£“ųÖŠŗ¬ÓŠ·įø»µÄµāŌŖĖŲ£¬µāŌŖĖŲŅŌµāĄė×ӵĊĪŹ½“ęŌŚ£®ŹµŃéŹŅ“Óŗ£“ųÖŠĢįČ”µāµÄĮ÷³ĢĶ¼ČēĶ¼1£ŗ£ØŅŃÖŖ£ŗCl2+2I-ØT2Cl-+I2£© ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
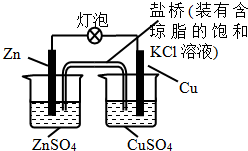
| A£® | Ņ»¶ĪŹ±¼äŗó£¬Ķ°ōÉĻÓŠŗģÉ«ĪļÖŹĪö³ö | |
| B£® | Õż¼«·“Ó¦ĪŖ£ŗZn-2e-=Zn2+ | |
| C£® | ŌŚĶāµēĀ·ÖŠ£¬µēĮ÷“ÓŠæ°ōĮ÷ĻņĶ°ō | |
| D£® | ŃĪĒÅÖŠµÄK+ŅĘĻņZnSO4ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
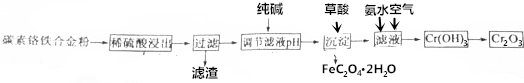
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com