
| 微粒 | 质子数 | 中子数 | 质量数 | 最外层电子数 | ZAX |
| Al | 27 | ||||
| S2- | 1634S2- |
分析 Al为13号元素,质量数为27,则含有13个质子,14个中子,1634S2-可说明质子数为16,中子数为18,带有2个负电荷,以此解答该题.
解答 解:Al为13号元素,质量数为27,则含有13个质子,14个中子,最外层电子数为13,可表示为1327Al,1634S2-可说明质子数为16,中子数为18,带有2个负电荷,最外层电子数为18,
故答案为:
| 微粒 | 质子数 | 中子数 | 质量数 | 最外层电子数 | ZAX |
| Al | 13 | 14 | 27 | 13 | 1327Al |
| S2- | 16 | 18 | 34 | 18 | 1634S2- |
点评 本题考查原子结构,为高频考点,注意把握原子的构成,把握核外电子排布特点,理解质量数与质子数、中子数的关系,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 对于同一个化学反应,一步完成和分几步完成,其反应的焓变不相同 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,断键吸热,成键放热 | |
| D. | 反应物的总焓大于反应产物的总焓时,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 硫代硫酸钠溶液中加入硫酸:S2O32-+6H++2SO42-═4SO2↑+3H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质类别 | 分类依据 | |
| A | 酸 | 电离时能否产生氢离子 |
| B | 碱性氧化物 | 是否属于金属氧化物 |
| C | 胶体 | 能否发生丁达尔现象 |
| D | 电解质 | 在水溶液中或熔化状态下能否电离 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同族元素的氧化物不可能形成不同类型的晶体 | |
| B. | SiO2晶体网状结构的最小的环上,Si和O原子数之比为1:2 | |
| C. | 满足难溶于水,熔点高,固体不导电,熔化时导电的晶体为离子晶体 | |
| D. | 同分异构体中,燃烧热数值越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2气体,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 氯气在水中溶解度大于饱和食盐水中的溶解度 | |
| D. | 由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | H2O中含有两个O-H共价键,故用氢气与氧气合成1 mol H2O放出的能量为926 kJ | |
| B. | 用单质合成1 mol H-Cl所放出的能量小于合成1 mol H-Br所放出的能量 | |
| C. | 当用表中卤素单质与氢气合成卤化氢时,所有的反应都是放热反应 | |
| D. | 合成溴化氢的热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=+103 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 98.32kJ | B. | 196.64kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
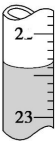 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com