


| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |

 (3分)
(3分) 
 。
。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:不详 题型:单选题
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mol
mol mol
mol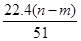 L
L +
+ )mol
)mol| A.5项 | B.4项 | C.3项 | D.2项 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使
的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使 还原为Xn+,则n的值为( )
还原为Xn+,则n的值为( )| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当转移1mol电子时,消耗56g S2O32- |
| B.在反应中硫元素被氧化,铁元素被还原 |
| C.还原剂是Fe2+,氧化剂是S2O32-和O2 |
| D.每生成1mol Fe3O4,转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: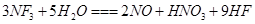 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是A. 是还原剂 是还原剂 |
B. 非极性分子,在潮湿空气中泄漏会看到红棕色气体 非极性分子,在潮湿空气中泄漏会看到红棕色气体 |
| C.每消耗0.2mol氧化剂,可收集到5.418L气体 |
D.若生成1mol  个电子 个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M | B.M+ | C.M2+ | D.M3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此反应是非氧化还原反应 |
| B.O2(PtF6) 中氧元素的化合价是+1价 |
| C.在此反应中,O2是氧化剂,PtF6是还原剂 |
| D.此反应中,每生成1mol O2(PtF6)转移1mol 电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com