
【题目】某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
(1)提出假设:①该反应的气体产物是CO2 . ②该反应的气体产物是CO.③该反应的气体产物是设计方案如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(2)查阅资料:氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式: .
(3)实验步骤:①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2 , 其作用分别为
(4)数据处理:试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
(5)实验反思:学习学习小组有同学认为应对实验装置进一步完善.①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 .
②此装置存在一定缺陷,请你指出 .
【答案】
(1)CO2、CO的混合物
(2)NH ![]() +NO
+NO ![]()
![]() ?N2↑+2H2O
?N2↑+2H2O
(3)反应前排尽装置内的空气、确保反应得到的CO2全部通过B装置
(4)Fe2O3+2C ![]() ?2Fe+CO↑+CO2↑
?2Fe+CO↑+CO2↑
(5)Ba(OH)2的溶解度大于Ca(OH)2 , 保证产生的CO2全部被装置B吸收,避免其逸出造成测定误差;没有尾气处理装置
【解析】解:(1)在还原氧化铁的反应中碳既可以被氧化生成CO,也可能被氧化生成CO2 , 故假设③应是CO2、CO的混合物,故答案为:CO2、CO的混合物;(2)发生氧化还原反应,铵根离子与亚硝酸离子生成氮气、水,反应离子方程式为NH ![]() +NO
+NO ![]()
![]() N2↑+2H2O,故答案为:NH4++NO2﹣
N2↑+2H2O,故答案为:NH4++NO2﹣ ![]() N2↑+2H2O;(3)实验过程中应防止空气参与反应,所以实验前用氮气排尽装置中的空气.实验结束后,为了把生成的气体全部排出,又需要用氮气排尽生成的气体,确保反应得到的CO2全部通过B装置, 故答案为:反应前排尽装置内的空气、确保反应得到的CO2全部通过B装置;(4)根据⑤可知生成物CO2的物质的量是
N2↑+2H2O;(3)实验过程中应防止空气参与反应,所以实验前用氮气排尽装置中的空气.实验结束后,为了把生成的气体全部排出,又需要用氮气排尽生成的气体,确保反应得到的CO2全部通过B装置, 故答案为:反应前排尽装置内的空气、确保反应得到的CO2全部通过B装置;(4)根据⑤可知生成物CO2的物质的量是 ![]() =0.02mol,其质量是0.88g,根据④可知反应中生成的气体共48.48g+3.2g+2.0g﹣52.24g=1.44g,因此CO的质量是1.44g﹣0.88g=0.56g,其物质的量是
=0.02mol,其质量是0.88g,根据④可知反应中生成的气体共48.48g+3.2g+2.0g﹣52.24g=1.44g,因此CO的质量是1.44g﹣0.88g=0.56g,其物质的量是 ![]() =0.02mol,即CO和CO2的体积之比是1:1,反应方程式为:Fe2O3+2C
=0.02mol,即CO和CO2的体积之比是1:1,反应方程式为:Fe2O3+2C ![]() 2Fe+CO↑+CO2↑,
2Fe+CO↑+CO2↑,
故答案为:Fe2O3+2C ![]() 2Fe+CO↑+CO2↑;(5)①氢氧化钙的溶解度小,吸收CO2的效果差,氢氧化钡的溶解度大,吸收CO2的效果要好,且碳酸钡的相对分子质量大于碳酸钙的,称量时误差小,
2Fe+CO↑+CO2↑;(5)①氢氧化钙的溶解度小,吸收CO2的效果差,氢氧化钡的溶解度大,吸收CO2的效果要好,且碳酸钡的相对分子质量大于碳酸钙的,称量时误差小,
故答案为:Ba(OH)2的溶解度大于Ca(OH)2 , 保证产生的CO2全部被装置B吸收,避免其逸出造成测定误差;
②CO有毒,因此要有尾气处理装置,故答案为:没有尾气处理装置.
(1)在还原氧化铁的反应中碳既可以被氧化生成CO,也可能被氧化生成CO2 , 故假设③应是CO2、CO的混合物;(2)发生氧化还原反应,铵根离子与亚硝酸离子生成氮气、水;(3)防止空气参与反应,实验前用氮气排尽装置中的空气.实验结束后,确保反应得到的CO2全部通过B装置;(4)根据⑤可知生成物CO2的物质的量是 ![]() =0.02mol,其质量是0.88g,根据④可知反应中生成的气体共48.48g+3.2g+2.0g﹣52.24g=1.44g,因此CO的质量是1.44g﹣0.88g=0.56g,其物质的量是
=0.02mol,其质量是0.88g,根据④可知反应中生成的气体共48.48g+3.2g+2.0g﹣52.24g=1.44g,因此CO的质量是1.44g﹣0.88g=0.56g,其物质的量是 ![]() =0.02mol,即CO和CO2的体积之比是1:1;(5)①氢氧化钙的溶解度小,吸收CO2的效果差,氢氧化钡的溶解度大,吸收CO2的效果要好,且碳酸钡的相对分子质量大于碳酸钙的,称量时误差小;
=0.02mol,即CO和CO2的体积之比是1:1;(5)①氢氧化钙的溶解度小,吸收CO2的效果差,氢氧化钡的溶解度大,吸收CO2的效果要好,且碳酸钡的相对分子质量大于碳酸钙的,称量时误差小;
②CO有毒,因此要有尾气处理装置.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】X-的核外电子排布为2、8、8,则X元素在周期表中的位置是( )
A.第三周期第0族B.第四周期第ⅠA族
C.第三周期第ⅠA族D.第三周期第ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物,F、H常温下呈气态,B常温下呈液态,其中F是人类生存不能离开的气体单质,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
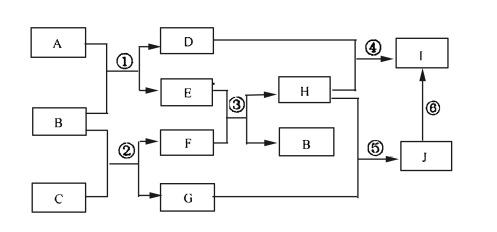
(1)写出C的电子式__________________。
(2)写出反应①的化学方程式______________________。
(3)列出两种E能发生的反应类型_________________________。
(4)写出过量的H与D溶液反应的离子方程式________________。
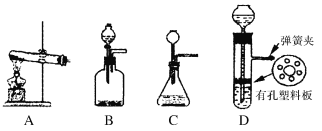
(5)实验室制取H的装置可以选用下列装置中的(填下图中的选项字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量浓度与50mL1mol/LAlCl3 溶液中Cl-物质的量浓度相等的是
A. 150mL2mol/LKCl溶液 B. 75mLlmol/LFeCl3溶液
C. 150mlL mol/LMgCl2溶液 D. 75mLlmol/LCuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石中的CaC2与H2O反应可用于制C2H2:CaC2+2H2O→C2H2↑+Ca(OH)2。通过排水测量出反应产生的气体的体积,从而可测定电石中碳化钙的含量。
(1)若使用下列仪器和导管组装实验装置,如下所示:
仪器和 导管 |
|
|
|
仪器和 导管 |
|
|
|
每个橡皮塞都打了两个孔 | |||
如果所制气体从左向右通过时,上述仪器和导管从左到右直接连接的顺序是(填仪器与导管的序号):
________接________接________接________接________接________。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下至不产生气体为止,关闭活塞。
正确的操作顺序是(用操作编号填空)________。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有________杂质。
(4)若实验时称取电石为1.60 g,测量出排水的体积后,折算成标准状况下乙炔的体积为448 mL,求此电石中碳化钙的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某微粒空间构型为平面三角形,则中心原子一定是sp2杂化
B.某微粒空间构型为V形,则中心原子一定有孤电子对
C.某微粒空间构型为三角锥形,则该微粒一定是极性分子
D.某微粒空间构型为正四面体,则键角一定是109°28’
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)在25℃下,向浓度均为0.1molL﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为 . 已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 .
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
= . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com