
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学取刚降落在热电厂附近的雨水进行实验.
①测得该雨水样品的pH为4.73;②向雨水样品中滴加BaCl2溶液,有白色沉淀生成;③每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
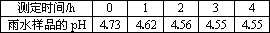
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为________.
(2)分析上述数据变化,你认为形成这一变化的原因是________.
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5 mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液.请计算(列出计算过程):
①该V L雨水中溶解SO2的体积(标准状况)为________mL.
计算过程:
②生成沉淀物的质量范围为________.计算过程:
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 加热 |
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 0.2 |
| t1 |
| 0.2 |
| t1 |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源:2013届江苏省高二上学期期中考试化学试卷 题型:填空题
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降落在热电厂附近的雨水进行实验。[来源:Z|xx|k.Com]
① 测得该雨水样品的pH为4.73;② 向雨水样品中滴加BaCl2溶液,有白色沉淀生成;③ 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
|
测定时间/h |
0 |
1 |
2 |
3 |
4 |
|
雨水样品的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为_________________________________。
(2)分析上述数据变化,你认为形成这一变化的原因是_____________________。
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算(列出计算过程):
① 该V L雨水中溶解SO2的体积(标准状况)为______________mL。
计算过程:
② 生成沉淀物的质量范围为________________________。计算过程:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源:上海模拟题 题型:填空题
 7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。
7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。 
 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2) 

查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降落在热电厂附近的雨水进行实验。
①测得该雨水样品的pH为4.73;
②向雨水样品中滴加BaCl2溶液,有白色沉淀生成;
③每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为 。
(2)分析上述数据变化,你认为形成这一变化的原因是
。
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。
请计算:①该V L雨水中溶解SO2的体积(标准状况)
②生成沉淀物的质量范围为 (列出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com