
分析 n(O)=4n(H2SO4)、N(H)=n(H2SO4)×2×NA;
H原子物质的量为H3PO4的3倍,而H原子物质的量等于HNO3的物质的量;
H3PO4、H2SO4分子均含有4个O原子,含有氧原子数目相等,则二者物质的量相等,根据N=nNA计算H2SO4分子数目.
解答 解:.5molH2SO4中,N(H)=0.5mol×2×NA/mol=NA,n(O)=4n(H2SO4)=4×0.5mol=2mol;
与0.2mol H3PO4有相同H原子数的HNO3为:$\frac{0.2mol×3}{1}$=0.6mol;
H3PO4、H2SO4分子均含有4个O原子,含有氧原子数目相等,则二者物质的量相等,H2SO4分子数目为0.2mol×6.02×1023mol-1=1.204×1023,
故答案为:NA;2;0.6;1.204×1023.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
 $\stackrel{③}{→}$C2H5Br,则反应①、②、③的反应类型分别为( )
$\stackrel{③}{→}$C2H5Br,则反应①、②、③的反应类型分别为( )| A. | 取代反应、加成反应、取代反应 | B. | 取代反应、取代反应、加成反应 | ||
| C. | 氧化反应、加成反应、加成反应 | D. | 氧化反应、加成反应、取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
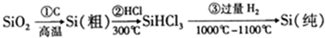 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移2mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

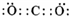 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分离方法 | 原理 | |
| A | 除去乙烯中乙炔:通入酸性高锰酸钾溶液中洗气 | 乙炔能与酸性高锰酸钾溶液反应,而乙烯不反应 |
| B | 分离硝基苯和苯:蒸馏 | 硝基苯和苯的沸点不同 |
| C | 除去丁酸乙酯中乙醇:加入饱和碳酸钠溶液,蒸馏 | 乙醇和丁酸乙酯的沸点不同 |
| D | 用丙醇和氯仿萃取碘水中碘 | 碘易溶于丙醇、氯仿 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
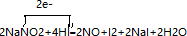 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
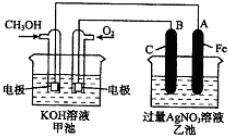
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 H2SO4 | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH-)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com