
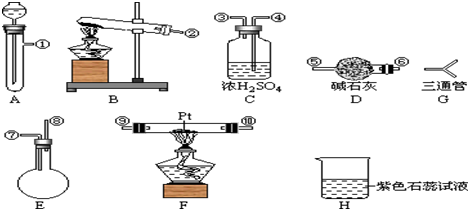
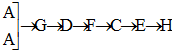 [按装置先后顺序排列]
[按装置先后顺序排列]分析 (1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,依据反应条件和反应物状态选择装置;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,据此选择装置及写出方程式;
双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,据反应物状态和反应条件选择发生装置并写出方程式;
(3)快速制NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,据此连接仪器;
(4)氨气与浓硫酸反应,可以用浓硫酸吸收过量的氨气和气体中的水蒸气;
(5)由于NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色.
解答 解:(1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,由于是两种气体之间的反应,所以根据装置的特点可知,应选择装置F制备;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;F;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,所以选择的装置是A,反应的化学方程式是NH3•H2O=NH3↑+H2O;
双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,反应物状态为固体与液体,条件不加热,选择装置A;方程式为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
故答案为:A;NH3•H2O=NH3↑+H2O;A;2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(3)快速制NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,所以正确的连接顺序是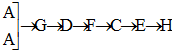 ;
;
故答案为: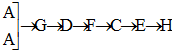 ;
;
(4)C中的浓硫酸用来吸收过来的氨气,干燥气体吸收水蒸气,故答案为:吸收多余NH3和水蒸气;
(5)由于NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色,反应的化学方程式是:4NO2+O2+2H2O=4HNO3;
故答案为:4NO2+O2+2H2O=4HNO3.
点评 本题考查气体的制备和性质的检验,熟悉发生装置选择的依据、氨气、氧气的制备原理和性质是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 65℃ | ---- | --- | 1mL | 100s |
| 2 | 65℃ | 10滴 | --- | 1mL | 90s |
| 3 | 75℃ | 10滴 | ---- | 1mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.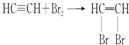
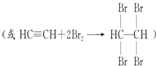 .
.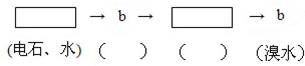
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com