
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 (b-2a)mol•L-1 | B. | 5(b-2a)mol•L-1 | C. | 2(b-a)mol•L-1 | D. | 10(2a-b)mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于稀硫酸中:Al+2H+═A13++H2↑ | |
| B. | 少量Cl2通入KI溶液中:Cl2+2I-═2C1-+I2 | |
| C. | 醋酸钠水溶液中通入足量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| D. | 碳酸锌溶于稀硝酸中:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) |
查看答案和解析>>
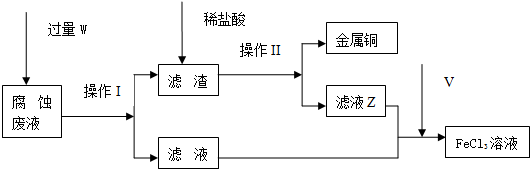
科目:高中化学 来源: 题型:填空题

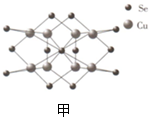
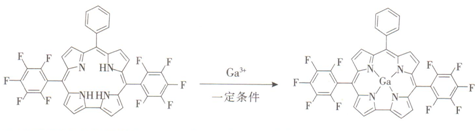
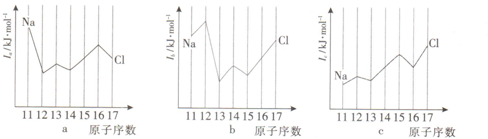
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | |
| B. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| C. | Se的非金属性比Br强 | |
| D. | 气态氢化物的稳定性比硫化氢气体弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 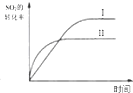 研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. | 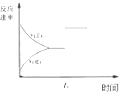 图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 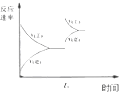 图中t0时增大压强,使平衡向正反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com