
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下22.4 L H2中含中子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 1molFe与足量O2或Cl2反应均失去3NA个电子 |
分析 A、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数即可;
B、氢原子的质量数为1,氢原子中的中子数为0;
C、醋酸属于弱电解质,溶液中只能部分电离出醋酸根离子和氢离子;
D、Fe与氧气反应生成四氧化三铁.
解答 解:A、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数=$\frac{46g}{46g/mol}$×3×NA=3NA,故A正确;
B、标况下22.4L氢气的物质的量为1mol,氢气分子中含有的中子数为0,故B错误;
C、1L 浓度为1mol•L-1的醋酸溶液中含有溶质醋酸1mol,醋酸为弱酸,1mol醋酸电离出的离子一定小于2mol,则醋酸溶液中含离子总数小于2NA,故C错误;
D、铁与氧气反应生成四氧化三铁,1molFe反应失去电子数不是3mol,故D错误,故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项B为易错点,注意氢气中不含中子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有分子的数目为0.5NA | |
| B. | 1mol/L CH3COOH溶液中含有CH3COOH分子的数目为NA | |
| C. | 78g 苯中含有碳碳双键的数目为3NA | |
| D. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色 | B. | 紫色 | ||
| C. | 蓝色 | D. | 视溶液的酸碱性待定H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和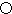 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.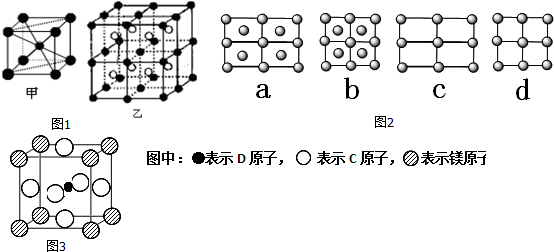
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该有机物的分子式为C12H12O6 | |
| B. | 该有机物的分子中只含有1个手性碳原子 | |
| C. | 可用FeCl3溶液检验该有机物质中是否含有苯酚 | |
| D. | 1mol该有机物最多可以和4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
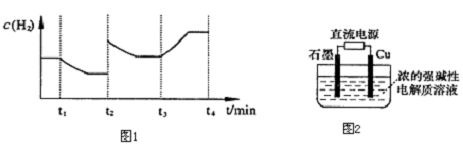
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  验证铁钉发生吸氧腐蚀 | |
| B. | 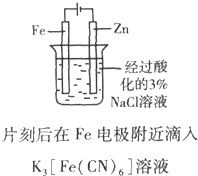 证明Fe电极被保护 | |
| C. | 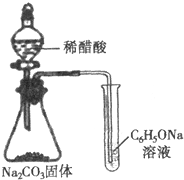 酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 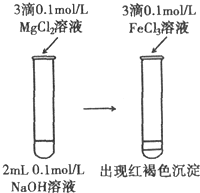 溶解度:Mg(OH)2>Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com