
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
| 0.02mol/L×0.05L-0.018mol/L×0.05L |
| 0.1L |
| Ksp(AgCl) |
| c(Cl-) |
| 1.8×10-10 |
| 0.001 |


科目:高中化学 来源: 题型:
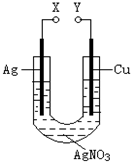
| A、X和Y不连接时,铜棒上会有金属银析出 |
| B、X和Y用导线连接时,银棒是正极,发生氧化反应 |
| C、若X接直流电源的正极,Y接负极,Ag+向铜电极移动 |
| D、无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2Y3 |
| B、XY |
| C、X2Y |
| D、XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水含有NA个H2O分子 |
| B、lmol Fe与足量氯气反应时失去的电子数为2NA |
| C、常温常压下,22.4LCl2含有2NA个Cl原子 |
| D、32g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X能形成化学式为X(OH)3的碱 |
| B、X能形成化学式为NaXO3的含氧酸钠盐 |
| C、X原子的最外层电子数和核电荷数不可能为偶数 |
| D、X能与某些金属元素或非金属元素形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2、MgO、Al2O3均属于碱性氧化物 |
| B、纯碱、烧碱、熟石灰均属于碱 |
| C、酸、碱、盐之间发生的反应均属于复分解反应 |
D、 混合物、分散系、胶体从属关系如图所示 混合物、分散系、胶体从属关系如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
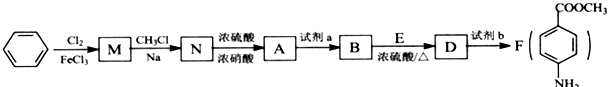
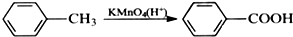
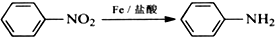
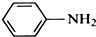 苯胺,弱碱性,-NH2易被氧化成-NO2
苯胺,弱碱性,-NH2易被氧化成-NO2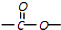 结构;
结构;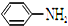 最多能够和
最多能够和查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com